
【题目】向NaOH和Na2CO3混合溶液中滴加0.1 mol·L1稀盐酸,CO2的生成量与加入盐酸的体积的关系如图。下列判断正确的是
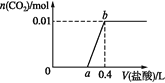
A. 在0~a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:![]()
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
【答案】C
【解析】
向氢氧化钠和碳酸钠的混合溶液中滴加盐酸,依次发生:H+和OH-的酸碱中和反应,H++CO32-=HCO3-,最后HCO3-+H+=H2O+CO2↑。生成的气体是0.01mol,所以碳酸氢根离子是0.01mol,根据碳守恒,Na2CO3为0.01mol。
A.在0~a范围内,除了发生酸碱中和,还发生H++CO32-=HCO3-,A错误;
B.ab段发生的反应是HCO3-+H+=H2O+CO2↑,B错误;
C. 0.01mol HCO3-消耗0.01mol H+,根据盐酸浓度0.1mol/L,从a到0.4消耗的盐酸为0.1L,所以a等于0.3,C正确;
D. a=0.3,在前两个反应中,共消耗0.03mol HCl,0.01mol Na2CO3消耗0.01mol HCl生成HCO3-,那么OH-消耗0.02mol H+,所以OH-为0.02mol,所以氢氧化钠和碳酸钠的物质的量之比是2:1,D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】判断乙醇与二甲醚互为同分异构体的依据是
A.具有相似的物理性质B.具有相似的化学性质
C.具有不同的分子组成D.分子式相同,但分子内原子间的连接方式不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol·L-1CuCl2溶液中滴入0.1ml·L-1的Na2S溶液,滴加过程中溶液中-1gc(Cu2+)随滴人的Na2S溶液体积的变化如图所示。下列叙述正确的是
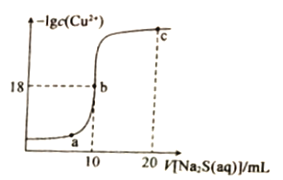
A. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)==2c(Na+)
B. Ksp(CuS)的数量级为10-36
C. a、b、c三点溶液中,b点水的电离程度最大
D. c点溶液中:c(C1-)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为某大型冶炼厂的冶炼加工的简化工艺流程。
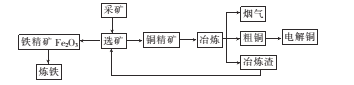
已知流程中“冶炼”的主要反应的化学方程式为Cu2S+O2 ![]() 2Cu+SO2
2Cu+SO2
(l)工业炼铁的主要设备是炼铁高炉,该设备中生成铁的主要反应的化学方程式为________
(2)“冶炼”产生烟气中的废气主要是 ___,从提高资源利用率和减排考虑,可将该烟气回收制备____。
(3)电解法炼铜时,阳极是 ___(填“纯铜板”或“粗铜板”);粗铜中含有的金、银以单的形式沉积在电解槽____(填“阳极”或“阴极”)的槽底,阴极的电极反应式是_____
(4)在精炼铜的过程中,电解质溶液中c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。
已知几种物质的溶度积常数(Ksp)如下表:

调节电解液的pH是除去杂质离子的常用方法。根据上表中溶度积数据判断,含有等物质的量浓度的Fe2+、Zn2+、Fe3+、Cu2+的溶液,随着pH的升高,最先沉淀下来的离子是____。一种方案是先加入过量的H2O2,再调节pH到4左右。加入H2O2后发生反应的离子方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知拆开1molH2(g)中的H-H键需要消耗436kJ能量,如图反应3H2(g)+N2(g) ![]() 2NH3(g)的能量变化示意图.下列说法不正确的是
2NH3(g)的能量变化示意图.下列说法不正确的是

A. 断开1 mol N2(g)中的N![]() N键要吸收941 kJ能量
N键要吸收941 kJ能量
B. 生成2mol NH3(g)中的N-H键吸收2346 kJ能量
C. 3H2(g) + N2(g) ![]() 2NH3(g) △H=-97
2NH3(g) △H=-97![]()
D. NH3(g) ![]() 3/2H2(g) +1/2 N2(g) △H=48.5
3/2H2(g) +1/2 N2(g) △H=48.5 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)基态Cu原子中,核外电子占据的最高能层的符号是___________,占据该能层电子的电子_云轮廓图形状为__________;Cu2+价层电子的轨道表达式(电子排布图)为___________。
(2)Cu2O熔点(1235℃)比Cu2S熔点(113℃)高,它们均属于___________晶体,前者熔点较高的原因是_________________________________。
(3)Cu可与N、S,O等元素形成化合物,N、S、O三种元素的第一电离能由大到小的顺序为______________;在Cu的催化作用下,乙醇可被氧化为乙醛,乙醛分子中碳原子的杂化方式是________________。
(4)1mo[Cu(NH3)4]SO4中含有σ键的数目为___________(用NA表示阿伏加德罗常数)。
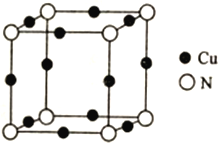
(5)Cu与N所形成的某种晶体的立方晶胞如图所示,其晶胞参数为amm。该晶体的化学式为___________,晶体的密度为___________g·cm-3(列出计算式即可,用NA表示阿伏加德罗常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 氯气溶于水:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 钠与水反应:Na+2H2O===Na+2OH+H2↑
C. 氧化亚铁溶于稀硝酸:FeO+2H+===Fe2++H2 O
D. 向碳酸氢铵溶液中加入足量石灰水:NH4++HCO3-+Ca2++2OH-===CaCO3 ↓+NH3·H2O+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有甲、乙两个化学小组利用两套相同装置,通过测定产生相同体积气体所用时 间长短来探究影响 H2O2 分解速率的因素(仅一个条件改变)。甲小组有如下实验设计方 案。
实验编号 | 温度 | 催化剂 | 浓度 |
甲组实验Ⅰ | 25 ℃ | 三氧化二铁 | 10 mL 5% H2O2 |
甲组实验Ⅱ | 25 ℃ | 二氧化锰 | 10 mL 5% H2O2 |
甲、乙两小组得出如下图数据。

(1)甲小组实验得出的结论是_____。
(2) 由乙组研究的酸、碱对 H2O2 分解影响因素的数据分析,相同条件下 H2O2 在______(填“酸”或“碱”)性环境下放出气体速率较快;由此,乙组提出可以用BaO2 固体与硫酸溶液反应制 H2O2,其反应的离子方程式为___________________________;支持这一方案的理由是_____。
(3)已知过氧化氢是一种极弱的二元酸:H2O2![]() H++HO2- (Ka1=2.4×10-12)。当稀 H2O2溶液在碱性环境下分解时会发生反应 H2O2+OH-
H++HO2- (Ka1=2.4×10-12)。当稀 H2O2溶液在碱性环境下分解时会发生反应 H2O2+OH-![]() HO2-+H2O,该反应中,正反应速率为 v 正=k正·c(H2O2)·c(OH-),逆反应速率为 v 逆=k 逆·c(H2O)·c(HO2- ),其中 k 正、k 逆为速率常数,则 k 正与 k 逆的比值为_________________________________________(保留 3 位有效数字)。
HO2-+H2O,该反应中,正反应速率为 v 正=k正·c(H2O2)·c(OH-),逆反应速率为 v 逆=k 逆·c(H2O)·c(HO2- ),其中 k 正、k 逆为速率常数,则 k 正与 k 逆的比值为_________________________________________(保留 3 位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com