
 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:解答题
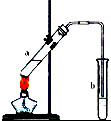 ①生成液体W的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;
①生成液体W的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
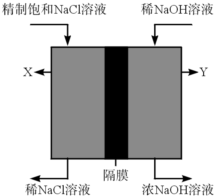 以海水为主要原料的海洋化学工业,被称为“蓝色化工”.氯碱工业是“蓝色化工”重要的组成部分,其化学反应原理是电解饱和食盐水.
以海水为主要原料的海洋化学工业,被称为“蓝色化工”.氯碱工业是“蓝色化工”重要的组成部分,其化学反应原理是电解饱和食盐水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铜丝与盐酸不反应,可以用铜丝代替铂丝做焰色反应 | |
| B. | 用铂丝蘸取某溶液在酒精灯的火焰上灼烧时,火焰呈黄色,说明原溶液中是钠盐 | |
| C. | 某溶液在灼烧时透过蓝色钴玻璃看到火焰呈紫色,说明原溶液中含有K+ | |
| D. | 所有的金属及其化合物都有焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠 | B. | 过氧化氢 | C. | 次氯酸钙 | D. | 硫酸亚铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
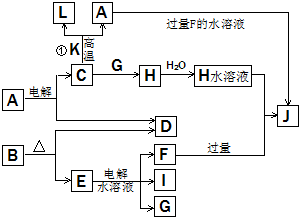 C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系:
C、D、G、I均为短周期元素形成的单质,D、G、I为常见非金属气态单质.D的最外层电子数是次外层电子数的3倍,C、G同周期,且最外层电子数相差4,它们的简单离子电子层结构不同.相互间有如下转化关系: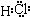 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com