
| A、NaCl中有杂质Na2SO4(氯化钡) |
| B、FeSO4中有杂质CuSO4(铁粉) |
| C、KCl溶液中有少量K2CO3(硫酸) |
| D、CO2中有少量CO(灼热的氧化铜) |


科目:高中化学 来源: 题型:
| 实验编号 | V(烧碱溶液)/mL | V(HCl)/mL | |
| 初读数 | 末读数 | ||
| 1 | 20.00 | 0.00 | 31.00 |
| 2 | 20.00 | 1.00 | 32.04 |
| 3 | 20.00 | 1.10 | 32.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
| A、+2590.4kJ/mol |
| B、-2590.4kJ/mol |
| C、+1295.2kJ/mol |
| D、-1295.2kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
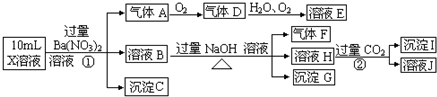
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 试剂 | 物质 | 试剂 |
| CuO(Al2O3) | FeCl3溶液(FeCl2) | ||
| NaHCO3溶液(Na2CO3) | Fe(Al) | ||
| C02(HCl) | Cu(Zn) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 L 1 mol?L-1的FeCl3溶液中含有NA个Fe3+ |
| B、标准状况下,22.4 L己烷中共价键数目为19NA |
| C、由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA |
| D、常温常压下的33.6 L氯气与27 g铝反应,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硅单质常用于制造太阳能电池和光纤 |
| B、石灰石在工业上常用制造水泥和玻璃 |
| C、碳酸氢钠在医疗上可用于治疗胃酸过多 |
| D、氧化铝可用于制造耐高温的容器 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com