
【题目】公安部发布法令:从2011年5月1日起,醉酒驾驶机动车将一律入刑。下列关于酒精的叙述错误的是( )
A.化学名称为乙醇
B.易挥发
C.常用作有机溶剂
D.不能被酸性高锰酸钾氧化
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ、某学生设计了一个实验以证明PbO中含有氧,反应方程式如下:
① PbO + C![]() Pb + CO (主要)
Pb + CO (主要)
② PbO + CO![]() Pb + CO2
Pb + CO2
③〔Cu (NH3 )2〕Ac + CO +NH3![]() 〔Cu (NH3 )3〕Ac·CO;△H<0(Ac-代表醋酸根离子此反应无明显现象)
〔Cu (NH3 )3〕Ac·CO;△H<0(Ac-代表醋酸根离子此反应无明显现象)
试根据下图回答问题:

(1) 盛澄清石灰水的试管开始一段时间可能没有现象,其原因是 。
(2) 烧杯中醋酸二氨合铜 (〔Cu (NH3 )2〕Ac ) 的作用为 。
(3) 实验后的醋酸二氨合铜经适当处理又可再生,适宜于再生的生产条件是 。(说明;不能加药品仅从生产条件考虑,以节约成本)
Ⅱ、图像分析是化学研究的一种重要的手段。某同学分析某无色透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入淡黄色粉末(过氧化钠)并加热,产生沉淀或气体的物质的量与淡黄色粉末的物质的量关系如图所示(假设产生的气体全部逸出)。请回答:
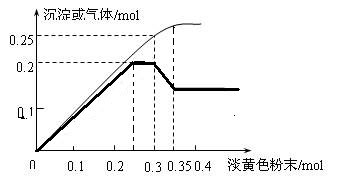
(1)根据图像所示,推测溶液中肯定有_____________离子。(写化学式)
(2)请写出曲线中过氧化钠物质的量在0.3~0.35mol时,粗的曲线出现下滑的现象,请用两个离子反应方程式解释该过程___________________,_________________.
(3)溶液中离子的物质的量之比为___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海藻灰中可以提取碘的主要反应为:2 I-+Cl2=2 Cl-+I2,下列说法正确的是)( )
A.该反应属于置换反应 B.I-具有氧化性
C.1mol氯气转移了1mol电子 D.Cl2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对有机物结构或性质的描述,错误的是
A. 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应
B. 乙二酸可与高锰酸钾溶液发生反应
C. 乙醇和乙烯的混合物1 mol,完全燃烧消耗 3 mol O2
D. 光照下, 2,2-二甲基丁烷与 Br2反应,其一溴取代物只有 2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,可以大量共存的离子组是( )
A.某无色溶液中:Na+、Cu2+、Cl-、MnO4-
B.含有大量Fe3+的溶液中:Na+、SO42-、K+、SCN- -
C.含有大量NH4+的溶液中:Ba2+、 K+、Cl-、OH-
D.在pH=1的溶液中:K+、Fe3+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:(Ⅰ)A是石油裂解气的主要成分,A的产量通常衡量一个国家的石油化工水平。
(Ⅱ)2CH3CHO+O2![]() 2CH3COOH
2CH3COOH
现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
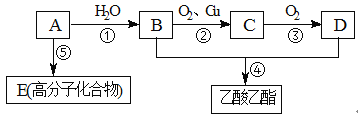
回答下列问题:
(1) 写出A的结构式 。
(2) B、D所含官能团的名称分别是 和 。
(3) 写出下列反应方程式及反应类型:
①方程式 ,反应类型 。
②方程式 ,反应类型 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化。下列说法正确的是( )
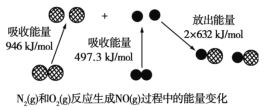
A.通常情况下,NO比N2稳定
B.通常情况下,N2(g)和O2(g)混合能直接反应生成NO
C.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的能量
D.1 mol N2(g)和1 mol O2(g)反应放出的能量为179.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在精制饱和食盐水中加入碳酸氢铵可制备小苏打(NaHCO3),并提取氯化铵作为肥料或进一步提纯为工业氯化铵。
完成下列填空:
(1)写出上述制备小苏打的化学方程式。____________________
(2)滤出小苏打后,母液提取氯化铵有两种方法:
①通入氨,冷却、加食盐,过滤
②不通氨,冷却、加食盐,过滤
对两种方法的评价正确的是__________(选填编号)
a.①析出的氯化铵纯度更高 b.②析出的氯化铵纯度更高
c.①的滤液可直接循环使用 d.②的滤液可直接循环使用
(3)提取的NH4Cl中含少量Fe2+、SO42-。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。
加热至沸的目的是____________________________。
滤渣的主要成分是_________________、_________________。
(4)称取1.840g小苏打样品(含少量NaCl),配成250ml溶液,取出25.00ml用0.1000mol/L盐酸滴定,消耗盐酸21.50ml。
实验中所需的定量仪器除电子天平外,还有__________________。
样品中NaHCO3的质量分数为__________________。(保留1位小数)
(5)将一定质量小苏打样品(含少量NaCl)溶于足量盐酸,蒸干后称量固体质量,也可测定小苏打的含量。若蒸发过程中有少量液体溅出,则测定结果______________。(选填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com