

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |

分析 含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MgCl2、CaCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2、MgCl2、CaCl2、MnCl2,向溶液中加入NaF溶液,除去钙镁离子,然后过滤得到的滤液中II中加入萃取剂,萃取后溶液加入草酸铵,得到草酸钴.
(1)亚硫酸钠具有还原性,能还原氧化性离子;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水;
(3)Fe3+、Al3+水解导致溶液呈酸性,碳酸根离子和氢离子反应,从而促进水解平衡向右移动;
(4)当加入过量NaF后,所得滤液$\frac{{c({M{g^{2+}}})}}{{c({C{a^{2+}}})}}$=$\frac{\frac{{K}_{sp}(Mg{F}_{2})}{{c}^{2}({F}^{-})}}{\frac{{K}_{sp}(Ca{F}_{2})}{{c}^{2}({F}^{-})}}$=$\frac{{K}_{sp}(Mg{F}_{2})}{{K}_{sp}(Ca{F}_{2})}$;
(5)根据图知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀;
(6)根据草酸的二级电离大于氨水的电离常数以及盐类水解的规律分析;
(7)由图可知,C点钴氧化物质量为8.03g,氧化物中氧元素质量为8.03g-5.9g=2.13g,据此求算氧化物中Co原子与O原子物质的量之比,确定Co的氧化物化学式.
解答 解:(1)亚硫酸钠具有还原性,能还原氧化性离子Fe3+、Co3+,所以浸出过程中加入Na2SO3的目的是将Fe3+、Co3+还原,还原为Fe2+、Co2+,
故答案为:还原Fe3+、Co3+为Fe2+、Co2+;
(2)NaClO3具有氧化性,能将浸出液中的Fe2+氧化成Fe3+,自身被还原生成氯离子,同时生成水,离子反应方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,
故答案为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O;
(3)Fe3+、Al3+水解导致溶液呈酸性,水解方程式为R3++3H2O?R(OH)3+3H+,:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,从而促进水解平衡向右移动,产生氢氧化铁、氢氧化铝沉淀,
故答案为:加入的碳酸钠(或CO32-)与H+反应,c(H+)降低,使Fe3+和Al3+(用R3+代替)的水解平衡R3++3H2O?R(OH)3+3H+,向右移动,而产生氢氧化物沉淀;
(4)当加入过量NaF后,所得滤液$\frac{{c({M{g^{2+}}})}}{{c({C{a^{2+}}})}}$=$\frac{\frac{{K}_{sp}(Mg{F}_{2})}{{c}^{2}({F}^{-})}}{\frac{{K}_{sp}(Ca{F}_{2})}{{c}^{2}({F}^{-})}}$=$\frac{{K}_{sp}(Mg{F}_{2})}{{K}_{sp}(Ca{F}_{2})}$=$\frac{7.35×1{0}^{-11}}{1.05×1{0}^{-10}}$=0.7,
故答案为:0.7;
(5)根据流程图可知,此时溶液中存在Mn2+、Co2+金属离子;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,可使Mn2+完全沉淀,并防止Co2+转化为Co(OH)2沉淀,
故答案为:3.0~3.5;
(6)盐类水解,谁强显谁性,NH3•H2O?NH4++OH- Kb=1.8×10-5,HCO4-?H++C2O42- K a2=5.4×10-5,所以(NH4)2C2O4溶液中铵根离子水解大于草酸根离子水解,溶液呈酸性,即PH<7,
故答案为:<;
(7)由图可知,C点钴氧化物质量为8.03g,0.1molCo元素质量为5.9g,氧化物中氧元素质量为8.03g-5.9g=2.13g,则氧化物中Co原子与O原子物质的量之比为0.1mol:$\frac{2.13g}{16g/mol}$≈3:4,故C的Co氧化物为Co3O4,
故答案为:Co3O4(或CoO•Co2O3).
点评 本题考查物质分离和提纯,为高频考点,题目难度中等,涉及溶度积常数计算、沉淀与pH的关系、盐类水解等知识点,明确实验原理是解本题关键,知道涉及的操作方法及发生的反应,难点是溶度积常数计算.


 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 全部由非金属元素组成的化合物中只含共价键 | |
| B. | 同一主族元素的单质熔点从上到下依次升高 | |
| C. | 某种元素的相对原子质量取整数,就是其质量数 | |
| D. | 第ⅦA族元素的阴离子还原性随着原子序数的递增逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ④ | B. | ⑤ | C. | ①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NCl3分子是非极性分子 | |
| B. | 分子中的所有原于均达到8电子稳定结构 | |
| C. | NBr3的熔点比NCl3的熔点低 | |
| D. | 分子中N-C1键键长比CCl4分子中C-C1键键长长 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
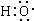
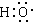 组成元素相同,含有的电子数也相同
组成元素相同,含有的电子数也相同

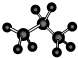
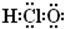
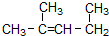 名称为1,3-二甲基-2-丁烯
名称为1,3-二甲基-2-丁烯| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚和乙酸都能与NaOH溶液反应 | |
| B. | 甲酸可发生银镜反应,而乙酸不能 | |
| C. | 苯酚能与氢氧化钠溶液反应 而乙醇不行 | |
| D. | 乙烯可发生加成反应,而乙烷不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②④②③① | C. | ④②③① | D. | ②④①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\stackrel{b+m+n}{a+m}R$ | B. | $\stackrel{a+b-m}{a+m}R$ | C. | $\stackrel{a+b}{a}R$ | D. | $\stackrel{a-m+b}{a-m}R$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com