
| Ԫ������ | Ԫ�ر�� | |||||
| �� | �� | �� | �� | �� | �� | |
| ԭ�Ӱ뾶/nm | 0.102 | 0.110 | 0.074 | 0.075 | 0.071 | 0.099 |
| ����ϼ� | +6 | +5 | +5 | +7 | ||
| ��ͻ��ϼ� | -2 | -3 | -2 | -3 | -1 | -1 |
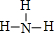
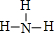
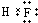
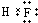
| ||
| �� |
| ||
| �� |
| ||
| ���¸�ѹ |
| ||
| ���¸�ѹ |
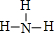 ��
��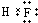 ��
��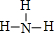 ��
��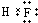 ��
��
| ||
| �� |
| ||
| ���¸�ѹ |
| ||
| �� |
| ||
| ���¸�ѹ |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Dz��ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۣ����ݱ�����Ϣ���ж�����������ȷ���ǣ�������
|
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��Ӧʱ�� | H2O | CO |
| 0 | 1.00 | 1.50 |
| t1 | 0.40 | |
| t2 | 0.90 |
| 0.3 |
| t1 |
| 0.3 |
| t1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�


| ���� |
| ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ����������ʵ���Һ�ҵ�Ʒ����������·�Ӧ��
����������ʵ���Һ�ҵ�Ʒ����������·�Ӧ��
| ||
| �� |
| �Լ� | ���� | �Ҵ� | ���� | �������� |
| �е㣨�棩 | 34.5 | 78.5 | 117.9 | 77 |
| ͬһ��Ӧʱ�� | ͬһ��ӦӦ�¶� | ||||
| ��Ӧ�¶�/�� | ת���ʣ�%�� | ѡ���ԣ�%��* | ��Ӧʱ��/h | ת���ʣ�%�� | ѡ���ԣ�%��* |
| 40 | 77.8 | 100 | 2 | 80.2 | 100 |
| 60 | 92.3 | 100 | 3 | 87.8 | 100 |
| 80 | 92.6 | 100 | 4 | 92.3 | 100 |
| 120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
| *ѡ����100%��ʾ��Ӧ���ɵIJ���ȫ��������������ˮ | |||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
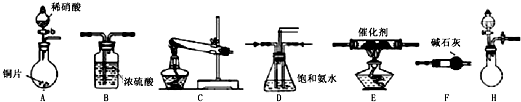
| �Լ������� | �����Լ� | NH3�����mL�� | |
| a | 6.0g Ca��OH��2�������� | 5.4g NH4Cl | 1344 |
| b | 5.4g ��NH4��2SO4 | 1364 | |
| c | 6.0g NaOH�������� | 5.4g NH4Cl | 1568 |
| d | 5.4g ��NH4��2SO4 | 1559 | |
| e | 6.0g CaO�������� | 5.4g NH4Cl | 1753 |
| f | 5.4g ��NH4��2SO4 | 1792 | |

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com