
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,下面判断正确的是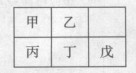
| A.原子半径:丙<丁<戊 |
| B.元素金属性:甲>丙 |
| C.氢氧化物碱性:丙<丁<戊 |
| D.丙的最高价氧化物水化物与戊的最高价氧化物水化物能发生反应 |
科目:高中化学 来源: 题型:单选题
短周期元素W、X、Y、和Z的原子序数依次增大,元素W是制造一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是电子层数的2倍。下列说法中错误的是:( )
| A.元素W、X的氯化物中,各原子均满足8电子的稳定结构。 |
| B.元素X与氢形成的原子比为1:1的化合物有很多种 |
| C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
| D.元素Z可与元素X形成共价化合物XZ2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
A、B、C均为短周期元素,A、B同周期,A、C的最低价阴离子分别为A2-、C-,A2-离子半径大于C-,B2+与C-具有相同的电子层结构。下列叙述中不正确的是
A.原子序数A>B>C B.离子半径A2->C->B2+
C.原子半径C>B>A D.最外层电子数C>A>B
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是
| A.Si是一种非金属主族元素,其晶体可用于制作计算机芯片 |
| B.工业上由NH3制碳铵属于氮的固定中的人工固氮 |
| C.Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
| D.S、P、Cl得电子能力和它们相应的最高价氧化物对应水化物的酸性均依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为11;Y、
Z在同一周期;Z原子最外层电子数是X原子内层电子数的2倍,也是Y原子最外层电子数的2倍。下列说法中,正确的是( )
| A.离子半径:Y>X | B.气态氢化物的稳定性:Z>X |
| C.Y的氧化物中含有离子键 | D.Z的氧化物对应的水化物是弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列事实与氢键有关的是
| A.HF、HCl、HBr、HI的热稳定性依次减弱 |
| B.水加热到很高的温度都难以分解 |
| C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高 |
| D.水结成冰体积膨胀 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素M、X、Y、Z,其中X、Y、Z在周期表中所处的位置如图所示。M元素原子的最外层电子数为其次外层电子数的2倍。X、Y、Z三种元素原子质子数之和为32。则下列说法正确的是( )
| X | | Z |
| | Y | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com