
【题目】已知:pKa= -lgKa,25℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1mol/LNaOH溶液滴定20mL 0.1mol/L H2SO3溶液的滴定曲线如图所示。下列说法不正确的是
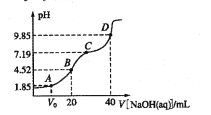
A. A点所得溶液中:Vo等于lOmL
B. B点所得溶液中:![]()
C. C点所得溶液中:![]()
D. D点所得溶液中水解平衡常数![]()
【答案】A
【解析】分析:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,结合亚硫酸的电离平衡常数分析;
B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,根据溶液中电荷守恒分析;
C.根据亚硫酸的电离平衡常数结合电荷守恒分析;
D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,根据水解常数与电离常数的关系计算。
详解:A.A点溶液中pH=1.85,则溶液中c(H+)=10-1.85mol/L,H2SO3的一级电离平衡常数为Ka1=c(H+)c(HSO3)/c(H2SO3)=10-1.85mol/L,所以c(H+)=Ka1,表明溶液中c(NaHSO3)=c(H2SO3),若恰好是10mLNaOH,由于此时溶液显酸性,则所得溶液中c(H2SO3)<c(NaHSO3),因此所加NaOH体积需<10mL,才能使溶液中c(NaHSO3)=c(H2SO3),即V0<10mL,A错误;
B.B点加入NaOH溶液的体积为20mL,此时反应恰好产生NaHSO3,为第一个滴定终点,溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3)+2c(SO32-)+c(OH-),B正确;
C.H2SO3的二级电离平衡常数为Ka2=c(H+)c(SO32-)/c(HSO3)=10-7.19mol/L,C点溶液的pH=7.19,即溶液中c(H+)=10-7.19mol/L,则c(H+)=Ka2,表明溶液中c(SO32-)=c(HSO3),溶液中存在电荷守恒,c(Na+)+c(H+)=c(HSO3)+2c(SO32-)+c(OH-),溶液显碱性,则溶液中c(Na+)>3c(HSO3),C正确;
D.D点为加入NaOH溶液40mL,此时溶液中恰好生成亚硫酸钠,为第二个滴定终点,此时亚硫酸钠水解使溶液显碱性,则Kh1=Kw/Ka2=1014/107.19=10-6.81,D正确。答案选A。


科目:高中化学 来源: 题型:
【题目】工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g)![]() CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。
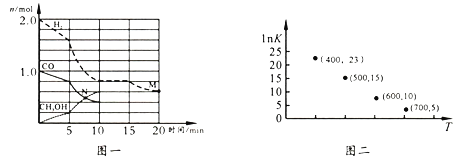
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
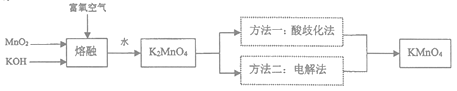
【题目】KMnO4是一种重要的氧化剂,广泛用于化学分析和化工生产以反水处理工业。工业上可由软锰矿(主要成分为MnO2)制备,目前有两种较为成熟的制法。其模拟流程如下图所示:
附表:不同温度下若干常见钾的化合物的溶解度(单位:g/(100gH2O))
化学式 | 20°C | 30°C | 40°C | 60°C | 80°C | 100°C |
CH3COOK | 256 | 283 | 324 | 350 | 381 | |
K2SO4 | 11.1 | 13 | 14.8 | 18.2 | 21.4 | 24.1 |
KCl | 34.2 | 37.2 | 40.1 | 45.8 | 51.3 | 56.3 |
KMnO4 | 6.34 | 9.03 | 12.6 | 22.1 | ||
K2CO3 | 111 | 114 | 117 | 127 | 140 | 156 |
(1)“熔融”时,可用作坩锅材质的是________________(填序号)。
A.氧化铝 B.陶瓷 C.氧化镁 D.石英
(2)写出MnO2和KOH熔融物中通入富氧空气时获得K2MnO4的化学方程式______________________。
(3)“酸歧化法”是在pH<6的情况下K2MnO4即可转化为MnO2和KMnO4,过滤除去MnO2,将滤液经过蒸发浓缩、趁热过滤得到KMnO4粗晶体,再经过重结晶获得较纯净的KMnO4晶体;
①根据表中的溶解度数据以及上述操作的特点,“酸歧化法”不适宜选择的酸性物质是________。
A.稀硫酸 B.醋酸 C.稀盐酸 D.二氧化碳
②“蒸发浓缩”时,温度需控制在70℃,适宜的加热方式是________________。
③根据相关方程式,计算“酸歧化法”的理论产率为_________________。
(4)“电解法”克服了“酸歧化法”理论产率偏低的问题,同时副产品KOH可用于软锰矿的焙烧。电解法制备高锰酸钾的实验装置示意图如下(图中阳离子交换膜只允许K+离子通过)
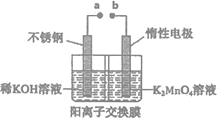
①a为______极(填“正”或“负”),右室发生的电极反应方程式为_______________。
②若电解开始时阳极区溶液为1.0L0.40mol·L-1K2MnO4溶液,电解一段时间后,右室中n(K)/m(Mn)为6:5,阴极区生成KOH的质量为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常温下,0.01 mol/L MOH溶液的pH为10,MOH(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1,强酸与强碱的稀溶液的中和热为ΔH=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A. -69.4 kJ·mol-1 B. -45.2 kJ·mol-1
C. +69.4 kJ·mol-1 D. +45.2 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的常见短周期元素,X的某种氢化物能使湿润的红色石蕊试纸变蓝.Y的一种核素质量数为18,中子数为10.在同周期元素中Z的简单离子半径最小,W的单质是良好的半导体材料。下列说法中正确的是
A. 简单气态氢化物稳定性:W >X
B. Y元素的相对原子质量为18
C. X2H4的分子中极性键和非极性键数目比为4:l
D. 电解Z的熔融氯化物可以冶炼单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+3B(g)![]() 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
A. v(A)=0.15mol/(Lmin)
B. v(B)=0.04mol/(Ls)
C. v(C)=0.03mol/(Ls)
D. v(D)=0.4mol/(Lmin)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.分液时,分液漏斗下层液体从下口流出,上层液体从也从下口流出
B.蒸发结晶时应将溶液蒸至有大量固体析出时
C.蒸馏时,应使温度计水银球靠近蒸馏烧瓶底部
D.称量时,称量物放在称量纸上置于托盘天平右盘,砝码放在托盘天平左盘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质分类的说法正确的是( )
A.盐酸、氯酸都属于含氧酸B.石灰水、石英都属于纯净物
C.烧碱、纯碱都属于碱D.Fe(OH)3胶体、稀豆浆都能产生丁达尔现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质名称中的“水”通常有三种含义:①表示水这种物质;②表示水溶液;③表示处于液态.下列物质名称中的“水”,不属于以上三种含义的是( )
A.蒸馏水
B.糖水
C.水银
D.水晶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com