
【化学——选修5:有机化学基础】(15分)5-氯-2,3-二氢-1-茚酮是是一种重要的医药中间体。
已知: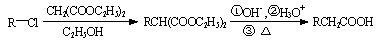
以化合物A(分子式为C7H7Cl)为原料合成5-氯-2,3-二氢-1-茚酮(化合物F)工艺流程如下:
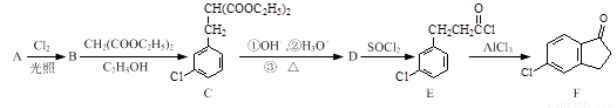
(1)写出A结构简式 ,反应E→F的反应类型 。
(2)化合物B中加入足量的氢氧化钠水溶液,在高温高压的条件并加合适的催化剂(所有卤素原子参与水解)反应的方程式 。
(3)某化合物是D的同分异构体,能使FeCl3溶液显紫色,且分子中只有3种不同化学环境的氢。写出该化合物的结构简式: (任写一种)。
(4)E→F的转化中,会产生一种与F互为同分异构体的副产物,其结构简式为 。
(5)根据已有知识并结合相关信息,写出以化合物F和CH2(COOC2H5)2为有机反应原料制备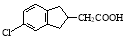 的合成路线流程图(注明反应条件)。合成路线流程图示例如下:
的合成路线流程图(注明反应条件)。合成路线流程图示例如下:
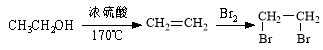
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
描述硅原子核外电子运动说法错误的是
A.有4种不同的伸展方向 B.有14种不同运动状态的电子
C.有5种不同能量的电子 D.有5种不同的运动范围
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,11.2 L CCl4中含有的分子数为0.5 NA
B.1 mol Cl2完全溶于水,转移的电子数为NA
C.25°C时,pH=13的1.0 L Ba(OH)2溶液中含有的OH数为0.1 NA
D.电解精炼铜,转移2 NA个电子时,阳极溶解64 g铜
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三4月质量检查理综化学试卷(解析版) 题型:填空题
[化学—有机化学基础〕(13分)尼泊金甲醋和香兰素在食品、化妆品行业有广泛用途。它们的结构简式如下:

(1)尼泊金甲醋中显酸性的官能团是 (填名称)。
(2)下列说法中,正确的是 (填标号)。
A.尼泊金甲醋和香兰素分子式都是C8H803
B.尼泊金甲醋和香兰素都能发生水解反应
C.1 mol尼泊金甲醋或香兰素均能与4mol H2发生加成反应
D.利用银氨溶液可以鉴别尼泊金甲酷和香兰素
(3)大茴香酸与香兰素互为同分异构体,它是一种羧酸,且具备以下3个特点。大茴香酸
的结构简式为 。
a.分子中含有甲基 b.遇FeC13溶液不显紫色 c.苯环上的一氯代物只有两种
(4)以丁香油酚为原料,通过下列路线合成香兰素。
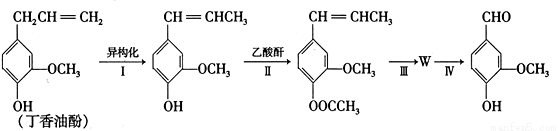
(注:分离方法和其他产物已经略去;乙酸酐的结构简式为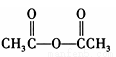 )
)
①由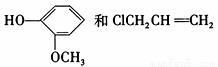 合成丁香油酚的反应类型为 。
合成丁香油酚的反应类型为 。
②步骤II中,反应的化学方程式为 。
③W的结构简式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三4月月考理综化学试卷(解析版) 题型:填空题
(14分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4,该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
6SO2+Fe3O4,该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________________(离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:___________________________。
(3)K2FeO4可作为一种“绿色高效多功能”水处理剂。原因是 。目前,人们针对K2FeO4的稳定性进行了大量的探索,并取得了一定的进展。下列物质中有可能提高化合物K2FeO4水溶液稳定性的是
A.亚硫酸钠 B.KOH C.醋酸 D.Fe(NO3)3
(4)K2FeO4与Zn组成新型二次电池高铁电池,电解液为碱溶液,其反应式为:
3Zn(OH)2+2Fe(OH)3+4KOH  3Zn+2K2FeO4+8H2O
3Zn+2K2FeO4+8H2O
放电时电池的负极反应式为_______;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省长沙市高三4月月考理综化学试卷(解析版) 题型:选择题
化学与人类社会的生产、生活有着密切联系。下列叙述中正确的是
A.苹果放在空气中久置变黄和纸张久置变黄原理相似
B.用活性炭为蔗糖脱色和用臭氧漂白纸浆,原理相似
C.钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀
D.黄河入海口沙洲的形成与用卤水点豆腐,都体现了胶体聚沉的性质
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南周口市高三3月教学质量监测理综化学试卷(解析版) 题型:简答题
(15分)焦炭与CO、H2均是重要的能源,也是重要的化工原料。
(1)已知C、H2、CO的燃烧热(△H)分别为-393.5 kJ·mol-1、-285.8kJ·mol-1、-283 kJ·mol-1,又知水的气化热为+44 kJ/mol。
①焦炭与水蒸气反应生成CO、H2的热化学方程式为___________________。
②若将足量焦炭与2mol水蒸气充分反应,当吸收能量为191.7 kJ时,则此时H2O(g)的转化率为_________________。
(2)将焦炭与水蒸气置于容积为2L的密闭容器中发生反应:C(s)+H2O(g) CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
CO(g)+H2(g),其中H2O、CO的物质的量随时间的变化曲线如图所示。
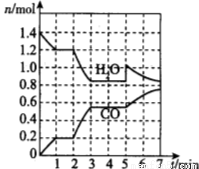
①第一个平衡时段的平衡常数是______________,若反应进行到2 min时,改变了温度,使曲线发生如图所示的变化,则温度变化为___________(填“升温”或“降温”)。
②反应至5 min时,若也只改变了某一个条件,使曲线发生如图所示的变化,该条件可能是下述中的____。
a.增加了C
b.增加了水蒸气
c.降低了温度
d.增加了压强
(3)假设(2)中反应在第2min时,将容器容积压缩至1 L,请在上图中绘制出能反映H2O、CO物质的量变化趋势的图像。
(4)若以CO、O2、K2CO3等构成的熔融盐电池为动力,电解400 mL饱和食盐水,则负极上的电极反应式为______________________,当有5·6g燃料被消耗时,电解池中溶液的pH=__________(忽略溶液的体积变化,不考虑能量的其它损耗)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省黄山市高三毕业班第二次质量检测理综化学试卷(解析版) 题型:选择题
电解Na2SO4溶液生Na2SO4和烧碱的装置如图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为1:2,下列有关说法正确的是(说明:阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)
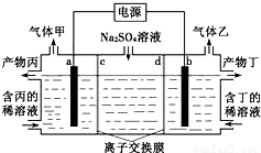
A.a极反应式为:2H++2e一=H2↑
B.产物丁为NaOH
C.c为阳离子交换膜
D.每转移0. 2mol电子,产生l 12L气体甲
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com