
| a | |||||||
| d | f | g | |||||
| b | c | e | h | ||||
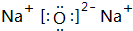 ,
,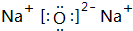 ;
;| 1mol |
| 1L |
| 0.75mol/L |
| 2min |
| 催化剂 |
| 催化剂 |


 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
| A、原子半径:W>X>Z>Y |
| B、热稳定性:H2Y>HZ |
| C、离子半径:W2+>Y2- |
| D、碱性:XOH>W(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 名称 | 普通漏斗 | 长颈漏斗 | 侧底烧瓶 | 蒸发皿 | 研钵 | 坩埚 | 烧杯 |
| 仪器 |  |
 |
 |
 |
 |
 |
 |
| 编号 | A | B | C | D | E | F | G |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 |
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
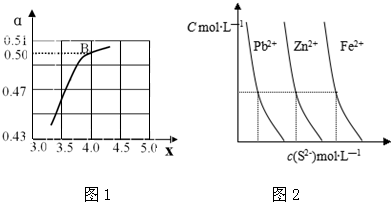
| n(NH3) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250°C | 300°C | 350°C |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com