
下列说法正确的是
A. 将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低
B. 0.l0mol·L-1的氨水加水稀释后,溶液中c(NH4+)、c(OH-)变大
C.常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变
D.若 LpH=11的NaOH溶液与
LpH=11的NaOH溶液与 LpH=3的HA溶液混合后显中性,则
LpH=3的HA溶液混合后显中性,则 ≤
≤
C
【解析】
试题分析:A、将pH=4的盐酸稀释后,溶液中氢离子和氯离子的浓度降低,但温度不变,Kw不变,氢氧根离子的浓度升高,错误;B、0.l0mol·L-1的氨水加水稀释后,虽然一水合氨的电离平衡正向移动,但由于溶液体积的增大起主要作用,溶液中c(NH4+)、c(OH-)变小,错误;C、Na2CO3水解呈碱性,常温下,向水中加入少量Na2CO3固体后,c(H+)会减小,但Kw不变,正确;D、V1LpH=11的NaOH溶液与V2LpH=3的HA溶液混合后显中性,若HA为强酸,则V1=V2,若HA为弱酸,则V1>V2,错误。
考点:考查电解质溶液的稀释、盐类的水解及酸碱混合的计算。


科目:高中化学 来源:2013-2014重庆市主城七区高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
下列说法正确的是
A.高熔点的固体如果不是离子晶体,则一定为原子晶体
B.由盐酸的酸性强于氢硫酸的酸性,可推知氧化性:Cl2>S
C.由两种元素组成的共价化合物分子中,只可能存在极性键
D.若X+ 和Y2-的核外电子层结构相同,则原子序数:X>Y
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:填空题
(11 分)(原创)能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
① | H2(g)+ | |||||||||
② | 2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; | |||||||||
③ | C(s)+ | |||||||||
④ | C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; | |||||||||
⑤ | CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H = + 802kJ/moL | |||||||||
化学键 | O=O | C-C | H-H | O-O | C-O | O-H | C-H | |||
键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 | |||
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式 。
(2)已知C(s)+ H2O(g) H2(g)+ CO(g)△H = ___________ kJ/moL;
H2(g)+ CO(g)△H = ___________ kJ/moL;
(3)估算出C=O键能为 kJ/moL。
(4)CH4的燃烧热△H = — ___________ kJ/moL。
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为_________mol[保留到小数点后2位;已知:c (H2O)=4.2 J/(g·℃) ]。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆一中高一下学期期末考试化学试卷(解析版) 题型:选择题
(原创) 下列化学用语使用正确的是
A.N2的结构式:N = N
B.H2O的比例模型:
C.HClO的电子式: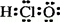
D.MgBr2的形成过程用电子式表示为: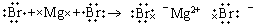
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:简答题
(15分)(1)25℃时,0.1 mol·L-1的HA溶液中c(H+)/c(OH-)=1010。请回答下列问题:
①HA是________(填“强电解质”或“弱电解质”);
②在加水稀释HA溶液的过程中,随着水量的增加而减小的是________(填字母)。
A.c(H+)/c(HA) B.c(HA)/(A-) C.c(H+)与c(OH-)的乘积 D.c(OH-)
③若M溶液是由上述HA溶液V1 mL与pH = 12的NaOH溶液V2 mL混合充分反应而得,则下列说法中正确的是
A.若溶液M呈中性,则溶液M中c(H+) + c(OH-) = 2.0×10-7 mol·L-1
B.若V1 =V2 ,则溶液M的pH一定等于7
C.若溶液M呈酸性,V1一定大于V2
D.若溶液M呈碱性,V1一定小于V2
(2)若已知在25℃,AgCl的Ksp = 1.8×10-10,现将足量AgCl分别放入:①100 mL 蒸馏水中;②100 mL 0.2mol·L-1 AgNO3溶液中;③100 mL 0.1mol·L-1 AlCl3溶液中;④100 mL 0.1mol·L-1盐酸中,充分搅拌后,相同温度下c(Ag+)由大到小的顺序是 (用序号连接)
(3)若1mol SO2(g)氧化为1mol SO3(g)的ΔH =-99kJ·mol-1,单质硫的燃烧热为296kJ·mol-1,则由S(s)生成3 mol SO3(g)的ΔH =
(4)对于2NO2(g) N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。
N2O4(g) ΔH < 0反应,在温度为T1,T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。则下列说法正确的是 。

①.A、C两点的反应速率:A>C
②.A、C两点气体的颜色:A深、C浅
③.B、C两点的气体的平均分子质量:B<C
④.由状态B到状态A,可以用加热方法
(5)下图是利用甲烷燃料电池电解50 mL 2 mol·L-1的氯化铜溶液的装置示意图:
请回答:
① 甲烷燃料电池的负极反应式是 。
② 当线路中有0.2 mol电子通过时,阴极增重____g。
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
用下图所示的装置制取、提纯并收集表中的四种气体,图中a、b、c表示相应仪器加入的试剂,未考虑尾气处理的问题,其中可行的是
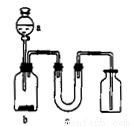
气体 | a | b | C | |
A |
| 浓氨水 | 生石灰 | 碱石灰 |
B |
| 稀硝酸 | 铜片 | 碱石灰 |
C |
| 浓硫酸 | 浓盐酸 | 氯化钙 |
D | SO2 | 浓硫酸 | 铜片 | 硅胶 |
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省大连市高三双基测试化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A. 硫酸铝溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓
B.向明矾溶液中滴加Ba(OH)2溶液至Al3+ 刚好沉淀完全:2Al3+ + 3SO42- + 3Ba2+ + 6OH- = 3BaSO4↓ + 2Al(OH)3↓
C.NH4HCO3溶于过量的NaOH溶液中:HCO3?+OH?=CO32?+H2O
D.稀硫酸中加入铁粉:2Fe+6H+=2Fe3++3H2↑
查看答案和解析>>
科目:高中化学 来源:2013-2014辽宁省高三仿真测试理科综合化学试卷(解析版) 题型:选择题
下列说法正确的是
A.在加热、甲醛、饱和(NH4)2SO4溶液、X射线作用下,蛋白质都会发生变性
B.氨基酸、蛋白质、油脂都含有C、H、O、N四种元素
C.生活中食用的食醋、植物油、动物蛋白等物质都是混合物
D.乙烯、聚乙烯、甲苯均能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三高考模拟理综化学试卷(解析版) 题型:简答题
雾霾天气严重影响人们的生活质量,其中氮氧化物和硫氧化物是造成雾霾天气的主要原因之一。消除氮氧化物和硫氧化物有多种方法。
(1)氮、氧元素非金属性较强的是 。
(2)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图1所示:
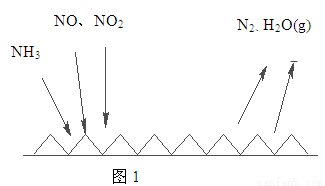
①由图1可知SCR技术中的氧化剂为 。
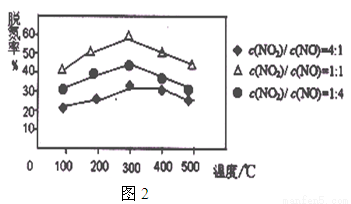
②用Fe做催化剂时,在氨气足量的情况下,不同c(NO2)/c(NO)对应的脱氮率如图2所示,脱氮效果最佳的c(NO2)/c(NO)= 。当NO2与NO的物质的量之比为1:1时,用氨脱氮,每生成1molN2放出的热量为QkJ,写出该反应的热化学方程式 。
(3)海水具有良好的吸收SO2的能力,其吸收过程如下:
①SO2溶于海水生成H2SO3,H2SO3最终会电离出SO32-,SO32-可以被海水中的溶解氧氧化为SO42-。海水的pH会 (填“升高” 、“不变”或“降低”)。
②SO2和O2在H2SO4溶液中可以构成原电池,其负极反应式是 。
(4)碲(Te)为ⅥA族元素,是当今高新技术新材料的主要成分之一。工业上可将SO2通入TeCl4的酸性溶液中进行“还原”得到碲,该反应的化学方程式是_________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com