
分析 氯化铁与硫化氢发生反应:2Fe3++H2S=2Fe2++S↓+2H+,与Fe发生反应:2Fe3++Fe=3Fe2+,由于Fe过量,生成的盐酸再和铁反应生成氯化亚铁,最终溶液为FeCl2溶液,由此分析解答.
解答 解:(1)氯化铁与硫化氢发生反应:2Fe3++H2S=2Fe2++S↓+2H+,故答案为:2Fe3++H2S=2 Fe2++S↓+2H+;
(2)通入0.672L标准状况下的H2S气体,气体完全被吸收,所以硫化氢中的氢全部转化为溶液中的氢离子,再加入过量的铁粉,则溶液中的氢离子全部转化为氢气,根据氢守恒,n(H2)=n(H2S),所以加入过量铁粉充分反应后产生氢气在标准状况下的体积为672mL,
答:加入过量铁粉充分反应后产生氢气在标准状况下的体积是672mL;
(3)化铁与硫化氢发生反应:2Fe3++H2S=2Fe2++S↓+2H+,与Fe发生反应:2Fe3++Fe=3Fe2+,由于Fe过量,生成的盐酸再和铁反应生成氯化亚铁,最终溶液为FeCl2溶液,最终溶液中0.15mol金属离子为Fe2+,
根据氯离子守恒:3n(FeCl3)=2n(FeCl2),即n(FeCl3)=$\frac{2}{3}$n(FeCl2)=0.15mol×$\frac{2}{3}$=0.1mol,
故原溶液中c(FeCl3)=$\frac{0.1mol}{0.2L}$=0.5mol/L,
答:原FeC13溶液的浓度为0.5 mo/L.
点评 本题考查混合物有关计算,明确发生的反应是解题关键,利用守恒法解答,避免方程式的繁琐,侧重考查学生分析计算能力,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与稀HNO3反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 向小苏打溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从物质的分类角度来看,油条配方中的“明矾、碱”均属于盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为:3CO32-+2KAl(SO4)2•12H2O═3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 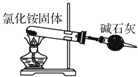 用装置来制备氨气 | |
| B. | 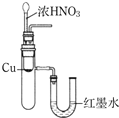 用装置来验证Cu与浓硝酸反应的热量变化 | |
| C. | 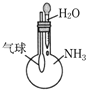 用装置来验证氨气极易溶于水 | |
| D. | 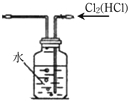 用装置来除去Cl2中混有的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ②
②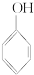 ③
③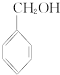 ④
④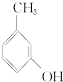 ⑤NaHSO 3溶液
⑤NaHSO 3溶液 查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | 3NO2+H2O=2HNO3+NO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com