
【题目】室温下,单质A、B、C分别为固体、黄绿色气体与无色气体,在合适条件下,它们可以按下面的流程进行反应。又知E溶液是无色的。请回答:

(1)写出E物质的化学式_______________。
(2)写出G→H的化学方程式_____________________________________________。
(3)写出B+F→D的离子方程式___________________________________________。
【答案】HCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe2++Cl2=2Fe3++2Cl-
【解析】
(1)由B为黄绿色气体且为单质,可知B为Cl2;由框图可知反应生成的固体D为固体单质A与Cl2反应生成的一种氯化物;反应生成的E为Cl2与气体单质C生成的一种可溶于水的氯化物,且E溶液和固体单质A又可以重新生成气体C和F,只有当C为H2,F为一种氯化物时才能满足这一过程;而A与Cl2反应已生成了一种氯化物D,F又是一种氯化物,所以A为变价金属,应为Fe,所以A为Fe,B为Cl2,C为H2,D为FeCl3,E为HCl,F为FeCl2,G为Fe(OH)2,H为Fe(OH)3,故答案为:HCl;
(2)G→H为Fe(OH)2和O2反应生成Fe(OH)3的反应,反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,故答案为:4Fe(OH)2+O2+2H2O=4Fe(OH)3;
(3)B+F→D的反应为Cl2和FeCl2生成FeCl3的反应,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-。


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)是一种黄色气体,熔点-64.5℃,沸点-5.5℃,易水解。它可以由C12与NO在常温常压下合成。请回答下列问题:

(1)制取原料气体NO、Cl2。其装置如图所示:
①装置a的名称是____________。
②制备干燥、纯净Cl2时,B装置中试剂是__________。
③制备NO时A装置中烧瓶内发生反应的化学方程式是_________________________。
(2)制备NOC1所需要的装置如图所示:

①正确的连接顺序为a→_______→_______→_______→_______→_______。
②已知NOC1分子中各原子都满足8e-稳定结构,其电子式为__________。
③向装置III中首先通人的气体是_________(填Cl2或NO),其目的是__________。
④装置IV中无水氯化钙的作用是______________。
⑤写出V中亚硝酰氯发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可划分为一次能源和- 二次能源,直接从自然界取得的能源称为一级能源,一次能源经过加工、转换得到的能源成为:二次能源。下列能源中属于一次能源的是
A. 氢能B. 电能C. 核能D. 水煤气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. ![]() 的一溴代物和
的一溴代物和![]() 的一溴代物都有4种(不考虑立体异构)
的一溴代物都有4种(不考虑立体异构)
B. CH3CH=CHCH3分子中的四个碳原子在同一直线上
C. 按系统命名法,化合物 的名称是2,3,4-三甲基-2-乙基戊烷
的名称是2,3,4-三甲基-2-乙基戊烷
D. ![]() 与
与![]() 都是α-氨基酸且互为同系物
都是α-氨基酸且互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:

(1)⑤和⑧的元素符号是________和________(填写元素符号,下同);
(2)表中最活泼的金属是________,非金属最强的元素是________;
(3)⑥的最高正价是________。
(4)⑦和⑩单质氧化性________强(填写元素符号);
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是
实验 | ① | ② | ③ |
电解条件 | 阴、阳极均为石墨 | 阴、阳极均为石墨, 滴加1mL浓硫酸 | 阴极为石墨,阳极为铁,滴加1mL浓硫酸 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 57.3 |
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72-+6e-+14H+═2Cr3++7H2O
C. 实验③中,Cr2O72-去除率提高的原因是Cr2O72-+6 Fe2++14H+═2Cr3++6Fe3++7H2O
D. 实验③中,理论上电路中每通过6mol电子,则有1molCr2O72-被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化亚铁的熔点674℃、沸点1023℃;三氯化铁在300℃以上易升华,易溶于水并且有强烈的吸水性。在500℃条件下氯化亚铁与氧气可能发生多种反应,反应之一为:12FeCl2 +3O2![]() 2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:
2Fe2O3 +8FeCl3。某研究小组选用以下装置(夹持装置省略,装置可重复选用)进行反应的探究。回答下列问题:


(1)装置的合理连接顺序为A、 、D,其中E装置U形管左边设计为粗导管的目的是 。
(2)A装置中发生反应的化学方程式为 。
(3)反应过程发现,装置B中除生成红棕色固体外,还观察到黄绿色气体,生成该气体的化学方程式为 。
(4)待B中充分反应后,停止加热后,还需持续通氧气至 。
(5)设计实验:
①利用E装置U形管里的固体验证Fe(OH)3是弱碱: 。
②测定装置B的残留固体中铁元素的质量分数: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X可用于合成Y.下列有关X、Y的说法正确的是( )
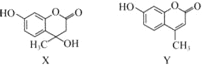
A. X分子中所有原子可能在同一平面上
B. X在一定条件下可以发生消去反应
C. Y与足量H2的加成产物中不含手性碳原子
D. X、Y与足量浓溴水反应的类型完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O![]() VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是
VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是

A. 全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O
B. 图中a电极为阴极,N物质是H2
C. 全钒液流电池充电时,V3+被氧化为VO2+
D. 电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com