
| ���� | CO2 | NH3 | NaHCO3 | NH4Cl | NaCl |
| �ܽ�ȣ�20�棩 | Vˮ��V������̼=1��1 | Vˮ��V����=1��700 | 9.6g | 37.2g | ag |
| 100g |
| 106g/mol |
| 50 |
| 53 |
| 50 |
| 53 |
| 100 |
| 53 |
| ||
| 2mol |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ���Ĵ�ʡ��Ԫ��ѧ2010��������Ĵ��¿�����ѧ�Ծ� ���ͣ�058
�ҹ�������ѧ�Һ�°����������ġ������Ƽ������ԭ�������ʸߣ����ܽ��������������Ӷ����������⣮�������Ƽ���Ļ�����������ʳ��ˮ��ͨ�백���Ͷ�����̼�����̼�����ƾ��壬�ٽ�����̼�����ƾ�����ȷֽ�ɵõ�������ķ�Ӧԭ���������л�ѧ����ʽ��ʾ��
NaCl(����)��NH3��CO2��H2O��NaHCO3����NH4Cl
2NaHCO3Na2![]() CO3��CO2��H2O
CO3��CO2��H2O
ij������ȤС��ͬѧ�����ա������Ƽ��ԭ�������������һ��ʵ��װ��

ʵ���ҿ�ѡҩƷ��Ũ��ˮ���������ʯ��ϡ���ᡢϡ���ᡢ��ʯ�ҡ��Ȼ�李��Ȼ���
(1)ѡ������ʵ��Լ�������D________
(2)��ʵ�������������У�Ӧ��ͨ________���壬��ͨ________���壻
(3)ָ����װ�õ���������________��________��________
(4)�ڸĽ�װ�ú�ͬѧ������ʵ�飬ʵ�����õı���NaCl��Һ�к�����58.5 g��ʵ�����õ���ˮ̼����26 g���������Ϊ________����ͬѧ�����ʵ��������������������ʧ��ԭ������������貢û�д�������Ҫԭ����________
(5)�ڡ������Ƽ���Ĺ�ҵ�����У�ԭ�ϵ������ʸߣ�����˳ɱ������ʱ�ʵ������Щ���ʿ��ظ����ã�________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ͬ���� ���ͣ�ʵ����
 Na2CO3+CO2��+H2O��ij������ȤС��ͬѧ�����ա������Ƽ��ԭ�����������ͼ��ʾ��һ��ʵ��װ�ã�
Na2CO3+CO2��+H2O��ij������ȤС��ͬѧ�����ա������Ƽ��ԭ�����������ͼ��ʾ��һ��ʵ��װ�ã� 
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ƽԭ���ǣ���NH3��CO2����ͨ�뱥��ʳ��ˮ�м��ɻ��NaHCO3��NH4Cl�Ļ���Ȼ������NaHCO3�ټ����Ƶô�����������£�
�����±���
| ���� | CO2 | NH3 | NaHCO3 | NH4Cl | NaCl |
| �ܽ�ȣ�20�棩 | Vˮ��V ������̼=1��1 | Vˮ��V����=1��700 | 9.6g | 37.2g | a g |
�ش��������⣺
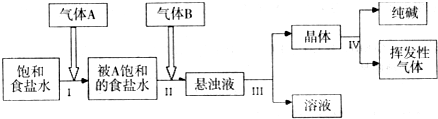
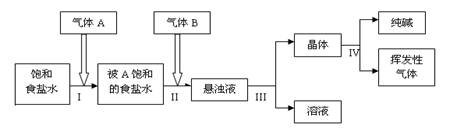
��1������A��B�����ǣ��� ��
A��CO2 �� NH3 B�� NH3 ��CO2 C���κ�˳����
��2��д����I���ͣ�II�������ܵĻ�ѧ��Ӧ����ʽ��
��
�ɷ�Ӧԭ����֪��a 9.6���<������>����=�� ��
��3��������III���������ǣ� ����ѧʵ���ҽ��иò����õ��IJ��������У� ��
��4�������裨III������Һ���к��е���Ϊ��д��ѧʽ���� ������ ����������ƣ�����Եõ����ʡ�
��5��ÿ��ͨ��NH3 44.8L�����ۺϳɱ�״���£�ʱ���Եõ�����100.0g����NH3��������Ϊ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com