
中和热的热化学方程式为:H+(aq)+OH (aq)=H2O(1) △H =-57.3kJ/mol
已知:CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O(1) △H =-Q1kJ/mol
1/2 H2SO4(浓)+NaOH(aq)=1/2Na2SO4(aq)+H2O(1) △H =-Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H =-Q3kJ/mol
上述反应均为溶液中的反应,则Q1、Q2、Q3的大小关系为( )
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:四川省绵阳中学2011届高三化学考前热点训练:05 离子反应与化学反应方程式 题型:013
|
下列用来表示物质变化的化学反应中.正确的是 | |
| [ ] | |
A. |
表示中和热的热化学方程式:H++OH- |
B. |
硫酸氢铵溶液与少量氢氧化钠溶液混合共热的离子方程式:NH4++OH- |
C. |
在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4的离子方程式: 3C1O- +2Fe(OH)3 2FeO42-+3C1-+H2O+4H+ 2FeO42-+3C1-+H2O+4H+
|
D. |
高锰酸钾酸性溶液与双氧水反应的离子方程式: 2MnO4- +5H2l8O2+6H+ 2Mn2++518O2↑+8H2O 2Mn2++518O2↑+8H2O
|
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市武清区杨村一中高二第一次月考化学试卷(带解析) 题型:填空题
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ?mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题: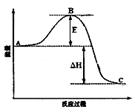
①图中C表示 E的大小对该反应的反应热有无影响? 。
②该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H=―24.8 kJ?mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H=―47.2 kJ?mol-1
③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ?mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届海南省三亚市高二上学期期中考试理科化学试卷(解析版) 题型:实验题
某实验小组用0.50 mol/L NaOH溶液和0.50 mol/L H2SO4溶液进行中和热的测定。
Ⅰ.配制0.50 mol/L NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,则至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器(填序号) 。
|
名称 |
托盘天平(带砝码) |
小烧杯 |
坩埚钳 |
玻璃棒 |
药匙 |
量筒 |
|
仪器 |
|
|
|
|
|
|
|
序号 |
a |
b |
c |
d |
e |
f |
Ⅱ.测定中和热的实验装置如图所示

(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3 kJ·mol-1):_______________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸进行实验,实验数据如下表。
①请填写下表中的空白:
|
温度 实验次数 |
超始温度t1/℃ |
终止温度t2/℃ |
平均温度差 (t2-t1)/℃ |
||
|
H2SO4 |
NaOH |
平均值 |
|||
|
1 |
26.2 |
26.0 |
26.1 |
30.1 |
|
|
2 |
27.0 |
27.4 |
27.2 |
33.3 |
|
|
3 |
25.9 |
25.9 |
25.9 |
29.8 |
|
|
4 |
26.4 |
26.2 |
26.3 |
30.4 |
②根据上述实验数据计算出的中和热为53.5 kJ/mol,这与中和热的理论值57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)______。
a.实验装置保温、隔热效果差
b.在量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源:2014届天津市高二第一次月考化学试卷(解析版) 题型:填空题
(10分)已知:a、H+(aq) + OH-(aq) = H2O(l) △H=-57.3 kJ•mol-1;
b、1.6gCH4完全燃烧生成水蒸气时放热80.2kJ,1g水蒸气转化成液态水放热2.444kJ。
(1)氢氧化钠与硫酸两稀溶液发生反应,写出表征其中和热的热化学方程式:
(2)写出表征甲烷燃烧热的热化学方程式:
(3)已知2SO2(g)+O2(g)  2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
2SO3(g)反应过程的能量变化如图所示。请回答下列问题:
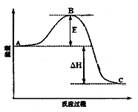
① 图中C表示 E的大小对该反应的反应热有无影响? 。
② 该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低? ,理由是 ;
(4)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
① Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) △H= ―24.8 kJ•mol-1
② 3Fe2O3(s)+ CO(g)=2Fe3O4(s)+ CO2(g) △H= ―47.2 kJ•mol-1
③ Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) △H= +640.5 kJ•mol-1
写出CO气体还原FeO固体得到Fe固体和CO2气体的热化学反应方程式:
_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com