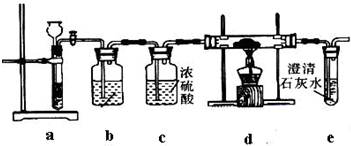
解答:解:
(1)依据碳酸性比苯酚的酸性强,弱酸盐与“强”酸发生的复分解反应,二氧化碳和苯酚钠反应生成苯酚,反应的方程式为:
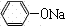
+CO
2+H
2O→
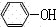
+NaHCO
3,
故答案为:
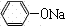
+CO
2+H
2O→
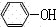
+NaHCO
3;
(2)加氢氧化钠溶液,氢氧化钠和苯酚反应生成溶于水的苯酚钠,乙酸和氢氧化钠反应生成乙酸钠;
苯酚钠和乙酸钠溶液通过二氧化碳,苯酚钠和二氧化碳、水反应生成碳酸氢钠和苯酚,而乙酸钠和二氧化碳不反应,苯酚在冷水中的溶解度较小,乙酸钠易溶于水,所以用分液的方法进行分离;
故答案为:分液;
(3)步骤1取少量苯酚放入a试管,加入少量蒸馏水,振荡,苯酚为有机物,在常温下在水中的溶解度不大,所以出现白色浑浊,步骤2:苯酚与溴发生取代反应,生成三溴苯酚白色沉淀,所以出现产生白色沉淀,苯酚和三氯化铁作用,形成络合物,呈现紫色,
故答案为:
| 实验操作 |
预期现象 |
现象解释 |
| 步骤1:取少量C放入a试管,加入少量蒸馏水,振荡. |
出现白色浑浊 |
苯酚常温下溶解度不大 |
| 步骤2:取少量C的稀溶液分装b、c两支试管,往b试管滴入过量饱和溴水,振荡. |
产生白色沉淀 |
苯酚与溴发生取代反应,生成三溴苯酚白色沉淀. |
| 步骤3:往c试管滴入几滴FeCl3溶液,振荡. |
溶液变为紫色 |
C与加入的试剂发生显色反应. |
(4)称取一定量的苯酚试样,用水溶解后全部转移至1000mL容量瓶中定容.取此溶液25.00mL,苯酚物质的量为原溶液的
,加入浓度为0.0500moL?L
-1的溴水溶液30mL,苯酚与溴水反应,是苯酚分子中羟基对苯环影响,邻对位氢原子活泼,易于取代反应的化学方程式为:
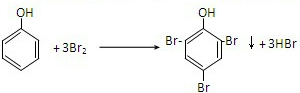
,从方程式可以看出1mol苯酚需3mol溴单质,1molBr
2~3mol苯酚,放置,待反应完全后,加入过量的KI,溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br
2+2KI=I
2+2KBr,从方程式可以看出1mol能氧化2mol碘化钾,生成1mol碘,根据I
2+2S
2O
32-=2I
-+S
4O
62-,知1mol碘需2molS
2O
32-,Br
2~2KI~I
2~2S
2O
32-,综上可知溴水总的物质的量为0.0500mol/L x 30.00 x 10
-3L,其中与碘化钾反应的溴为
x 0.1100 mol/L x 11.80 x 10
-3L,所以试样中C物质的量:(0.0500mol/L x 30.00 x 10
-3L-
x 0.1100 mol/L x 11.80 x 10
-3L)x
x 40;
故答案为:(0.0500mol/L x 30.00 x 10
-3L-
x 0.1100 mol/L x 11.80 x 10
-3L)x
x 40;


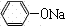 +CO2+H2O→
+CO2+H2O→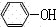 +NaHCO3
+NaHCO3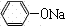 +CO2+H2O→
+CO2+H2O→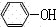 +NaHCO3
+NaHCO3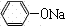 +CO2+H2O→
+CO2+H2O→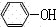 +NaHCO3,
+NaHCO3,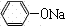 +CO2+H2O→
+CO2+H2O→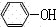 +NaHCO3;
+NaHCO3; ,从方程式可以看出1mol苯酚需3mol溴单质,1molBr2~3mol苯酚,放置,待反应完全后,加入过量的KI,溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br2+2KI=I2+2KBr,从方程式可以看出1mol能氧化2mol碘化钾,生成1mol碘,根据I2+2S2O32-=2I-+S4O62-,知1mol碘需2molS2O32-,Br2~2KI~I2~2S2O32-,综上可知溴水总的物质的量为0.0500mol/L x 30.00 x 10-3L,其中与碘化钾反应的溴为
,从方程式可以看出1mol苯酚需3mol溴单质,1molBr2~3mol苯酚,放置,待反应完全后,加入过量的KI,溴的氧化性比碘的氧化性强,故溴单质能从KI中置换出碘单质,即Br2+2KI=I2+2KBr,从方程式可以看出1mol能氧化2mol碘化钾,生成1mol碘,根据I2+2S2O32-=2I-+S4O62-,知1mol碘需2molS2O32-,Br2~2KI~I2~2S2O32-,综上可知溴水总的物质的量为0.0500mol/L x 30.00 x 10-3L,其中与碘化钾反应的溴为