
科目:高中化学 来源: 题型:
 、
、 (任写两种)
(任写两种) 、
、 (任写两种)
(任写两种)



| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
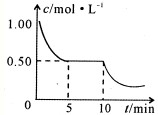
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2012?河西区一模)碳和碳的化合物在生产、生活中的应用非常广泛,此方面的科学研究为当今提倡的“低碳生活方式”提供依据.请按要求回答下列问题:
(2012?河西区一模)碳和碳的化合物在生产、生活中的应用非常广泛,此方面的科学研究为当今提倡的“低碳生活方式”提供依据.请按要求回答下列问题:
| ||
| ||
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | |
| N2 | 8.00 | 7.40 | 7.00 | 6.72 | 6.52 | 6.36 | 6.20 | 6.00 | 6.00 | 6.00 |
| CO | 0.00 | 1.80 | 3.00 | 3.84 | 4.22 | 4.92 | 5.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.
(2010?祁阳县一模)一氧化碳、二氧化硫和氮的氧物是重要的化工原料,但也是大气的主要污染物,综合治理其污染是环境化学当前的重要研究内容之一.查看答案和解析>>
科目:高中化学 来源:2010年湖南省永州市祁阳县高考化学一模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com