
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应SO2(g)+NO2(g) SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如下所示。由图可得出的正确结论是
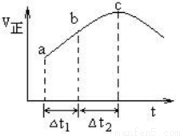
A. 反应在c点达到平衡状态
B. 反应物浓度:a点小于b点
C. 反应物的总能量低于生成物的总能量
D. △t1=△t2时,SO2的转化率:a~b段小于b~c段
科目:高中化学 来源:2016-2017学年河北省高二上第二次月考化学试卷(解析版) 题型:选择题
下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.高压比常压有利于合成SO3
C.加入催化剂有利于氨的合成
D.工业制取金属钾Na(l)+KCl(l) NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
NaCl(l)+K(g)选取适宜的温度,使K变成蒸气从反应混合物中分离出来
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁省高二下期初摸底化学卷(解析版) 题型:填空题
大苏打(Na2S2O3·5H2O)、苏打、小苏打被称为“三苏”,它们在生 活、生产中用途广泛。
活、生产中用途广泛。
(1)工业上,将苏打和硫化钠以1:2的物质的量之比配成溶液,再通入SO2气体,可制得Na2S2O3,同时放出CO2。写出该反应的化学方程式 。硫化钠溶液在空气中久置,会生成淡黄色物质,经测定该物质具有与过氧化钠相似的结构,该物质的化学式 。
(2)Na2S2O3标准液常用于滴定碘的含量,若滴定的溶液呈酸性,测定结果会偏高,用离子方程式表示其原因 。
(3)工业上用大苏打溶液吸收工业废气中的氯气,其氧化产物为SO42-,写出离子方程式 。
(4)工业上常用苏打和盐酸除去锅炉中水垢中的硫酸钙。先用饱和苏打溶液浸泡锅垢,然后用盐酸清洗。“浸泡”的目的是 。(并用离子方程式表示)
(5)在密闭的容器中投入一定量的Na2O2和NaHCO3固体,在300℃下充分反应。若残留固体为纯净物,则起始时n(NaHCO3):n(Na2O2)满足的条件是 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上8月考试化学卷(解析版) 题型:填空题
在一个温度和体积不变的容器中,硫可以发生如下变化,其反应过程和能量关系如图1所示。(SO2(g)+1/2O2(g) SO3(g) △H=-98.45kJ·mol-1)
SO3(g) △H=-98.45kJ·mol-1)

(1)硫燃烧的热化学方程式为 。
(2)恒容条件下,下列措施中能使n(SO3)/n(SO2)比图1所示情况增大的有 。
A.降低温度 B.充入He C.再充入1mol SO2(g)和1mol O2(g) D.使用催化剂
(3)恒温恒容时,图1中II到III反应放出的热量比1mol SO2和2mol O2充分反应放出的热量 (填
“大”、“小”或“相等”)。
(4)某SO2(g)和O2(g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。(如t1~t2、t3~t4、t5~t6、t6~t7等)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广东省高二上8月考试化学卷(解析版) 题型:选择题
对于密闭容器中进行的反应CO(g)+H2O(g) CO2(g)+H2(g),达到平衡后,其它条件不变,增大CO的浓度,下列说法错误的是
CO2(g)+H2(g),达到平衡后,其它条件不变,增大CO的浓度,下列说法错误的是
A.正反应速率增大
B.逆反应速率先减小
C.达到平衡时,逆反应速率比原平衡要大
D. 化学平衡常数不变
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一上第一次月考化学试卷(解析版) 题型:实验题
某次实验需配制0.4mol•L-1NaOH溶液500mL.配制方法如下:
(1)配置该溶液所需玻璃仪器除烧杯、量筒、玻璃棒外还需________和______________;
(2)用托盘天平准确称量___________g固体NaOH;
(3)将称量好的NaOH固体放在500mL大烧杯中,倒入约300mL蒸馏水,用玻璃棒搅拌,使固体全部溶解,待______________后,将烧杯中的溶液注入容量瓶中;
(4)用少量蒸馏水洗涤烧杯以及玻璃棒2~3次,洗涤后的溶液____ _,轻轻晃动容量瓶,使溶液混合均匀;
(5)向容量瓶中加入蒸馏水,到液面__ ___时,改用胶头滴管加蒸馏水至液面与刻度线相切.盖好瓶塞,倒转摇匀,装入细口瓶贴上标签.
(6)下列情况对所配制浓度有何影响?(用偏大、偏小、无影响填写)
A.所用的固体NaOH长时间放置在密封不好的容器中______________
B.容量瓶用蒸馏洗涤后残留有少量的水______________
C.定容时俯视溶液的液凹面______________
(7)如果加水定容时超出了刻度线,会造成溶液浓度___________,不能将超出部分再吸走,须_ ____.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学考试化学试卷(解析版) 题型:填空题
在一定温度下,向一固定容积的密闭容器中加入 1mol A和 2mol B,发生下述反应:A(g)+2B(g)  3C(g)+2D(s)(放热反应)。达到平衡时生成了1.8 mol C。
3C(g)+2D(s)(放热反应)。达到平衡时生成了1.8 mol C。
(1)在相同条件下,若向该容器中改为加入0.3mol A、0.6 mol B,要使平衡混合气体中C物质的体积分数与原平衡的相同,在D足量时,则还应加入 mol的物质C。
(2)若维持容器的体积和温度不变,反应从逆反应方向开始,按不同的配比作为起始物质,达到平衡时C仍为1.8 mol 。则D的起始物质的量n(D)应满足的条件是:n(D)___________。
当改变温度或压强时,有可能改变物质的聚集状态,对平衡产生重大影响。
(3)若升高平衡体系温度,当再次达到平衡后,测得两次平衡条件下混合气体的平均相对分子质量未发生改变,试解释形成这种结果的可能原因是:_____________________;
(4)若将容器改为容积可变的容器,在一定温度和常压下,建立上述平衡之后,A的物质的量浓度为a mol/L。现持续增大压强,当:
①当压强为原来1.5倍时,A的平衡时物质的量浓度为m mol/L,测得m=1.5a;
②当压强为原来10倍时,A的平衡时物质的量浓度为n mol/L,测得n >10 a;
③当压强为原来100倍时,A的平衡时物质的量浓度为p mol/L,测得p<100a。
试解释形成这种结果的可能的原因:
①1.5倍时: ;
②10倍时: ;
③100倍时: 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省高二上开学考试化学试卷(解析版) 题型:选择题
将H2(g)和Br2(g)充入恒容密闭容器,恒温下发生反应H2(g)+Br2(g)  2HBr(g)
2HBr(g)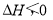 平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
平衡时Br2(g)的转化率为a;若初始条件相同,绝热下进行上述反应,平衡时Br2(g)的转化率为b。a与b的关系是( )
A. a>b B. a=b C. a<b D. 无法确定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北沙市高二上第一次双周练化学卷(解析版) 题型:选择题
将Υ1 L的H2和Υ2 L的N2在一定条件下发生反应,达到平衡后,混合气体总体积为Υ3 L(气体体积均在相同条件下测定),则生成NH3的体积是( )
A.(Υ1+Υ2-Υ3)L B.(Υ1+Υ2+Υ3)L
C.(Υ1+Υ2-2Υ3)L D. [Υ3-(Υ1+Υ2)] L
[Υ3-(Υ1+Υ2)] L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com