��2013?���죩ij�о�С��������9ͼװ��̽���¶ȶ�CO��ԭFe
2O
3��Ӱ�죨�̶�װ���ԣ�
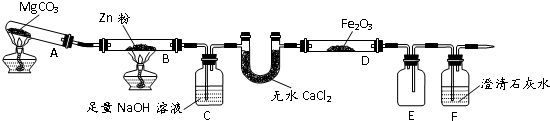
��1��MgCO
3�ķֽ����Ϊ
MgO��CO2
MgO��CO2
��
��2��װ��C��������
��CO2
��CO2
������β���ķ���Ϊ
��ȼ
��ȼ
��
��3�����о�С���Ϊ���飬����9ͼװ�ý��жԱ�ʵ�飬�����þƾ��ơ������þƾ���ƶ�װ��D���ȣ���Ӧ�����Ϊ��ɫ��ĩ�������������ֱ��ò����������ʵ�飮
| ���� |
���� |
�������� |
�������� |
| 1 |
ȡ��ɫ��ĩ����ϡ���� |
�ܽ⣬������ |
�ܽ⣬������ |
| 2 |
ȡ����1����Һ���μ�K3[Fe��CN��6]��Һ |
��ɫ���� |
��ɫ���� |
| 3 |
ȡ����1����Һ���μ�KSCN��Һ |
��� |
������ |
| 4 |
����3��Һ�еμ�������ˮ |
��ɫ��ȥ |
�ȱ�죬����ɫ |
������õ��ĺ�ɫ��ĩ��
Fe
Fe
��
�ڼ��鲽��1�з�Ӧ�����ӷ���ʽΪ
Fe3O4+8H+=Fe2++2Fe3++4H2O
Fe3O4+8H+=Fe2++2Fe3++4H2O
��
�����鲽��4�У���Һ����ԭ��Ϊ
Fe2+������ΪFe3+��Fe3+��SCN-�Ժ�ɫ
Fe2+������ΪFe3+��Fe3+��SCN-�Ժ�ɫ
����Һ��ɫ���ܵ�ԭ������֤����Ϊ
����SCN-��Cl2����������Һ�м���KSCN��Һ�������ֺ�ɫ����������
����SCN-��Cl2����������Һ�м���KSCN��Һ�������ֺ�ɫ����������
��
�ܴ�ʵ�鰲ȫ���ǣ���9ͼװ�û��ɲ�ȡ�ĸĽ���ʩ��
��װ��B��C֮������װ��E���Է�����
��װ��B��C֮������װ��E���Է�����
��




 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
 ��2013?����һģ����1������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
��2013?����һģ����1������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�


