


科目:高中化学 来源: 题型:
| A、是离子化合物,含有离子键和共价键 |
B、电子式是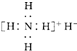 |
| C、与水反应时,是还原反应 |
| D、固体投入少量的水中,有两种气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、银质物品久置表面变暗 |
| B、远洋海轮的尾部装上一定数量的锌板 |
| C、常温条件下,在空气中铝不易被腐蚀 |
| D、用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于金属键具有方向性与饱和性,所以金属在外加电场作用下导电 |
| B、金属键是金属阳离子与自由电子间的相互作用 |
| C、氢键、配位键都是特殊的共价键 |
| D、离子晶体中只存在离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A Z |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、35Cl原子所含质子数为18 | ||
B、
| ||
| C、3.5g35Cl2气体的体积为1.12L | ||
| D、已知自然界中氯元素的平均相对原子质量为35.5,则37Cl的质量分数为25% |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知25℃时有关弱酸的电离平衡常数:
已知25℃时有关弱酸的电离平衡常数:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com