
 2013��9�£��й��������е������������ص������������������ӱ������ϵȵصĿ�����Ⱦ��Ϊ6��������Ⱦ�������ض���Ⱦ������β����ȼú����������ȡů�ŷŵ�CO2�ȶ��������γɵ�ԭ��
2013��9�£��й��������е������������ص������������������ӱ������ϵȵصĿ�����Ⱦ��Ϊ6��������Ⱦ�������ض���Ⱦ������β����ȼú����������ȡů�ŷŵ�CO2�ȶ��������γɵ�ԭ��| ���� |
| ʵ���� | �¶� �� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
| m |
| V |
| m |
| n |
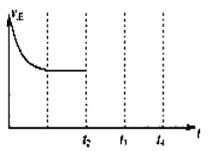
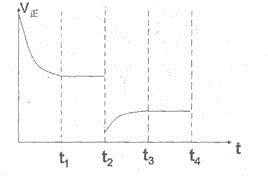 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��| c(CO2)c(H2) |
| c(H2O)c(CO) |
| 0.8��0.8 |
| 0.2��1.2 |
| 1.6 |
| 4 |
| 0.4 |
| 2 |


 ȫ�ܲ����ĩС״Ԫϵ�д�
ȫ�ܲ����ĩС״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ���ǣ�������
���ΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ���ǣ�������| A��ԭ�Ӱ뾶��X��W��Y |
| B��Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ |
| C��W���⻯���X���⻯���ȶ� |
| D��YԪ�ص�����������Ӧˮ�����WԪ�ص�����������Ӧˮ���������ǿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NaHSO4��Һ��Ba��OH��2��Һ��Ϻ���Һ�����ԣ�2H++SO42-+Ba2++2OH-=BaSO4��+2H2O | ||||
| B������״����112 mL����ͨ��10 mL 1 mol?L-1���廯������Һ�У�2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
C���ö��Ե缫��ⱥ��MgCl2��Һ��2Cl-+2H2O
| ||||
| D�������ʯ��ˮ�м��������̼��������Һ��Ca2++OH-+HCO3-=CaCO3��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������֪Ũ�ȵ�����ζ�δ֪Ũ�ȵ�����������Һʱ����ȡ�ζ���ĩ����ʱ�����ӿ̶��� |
| B���ⶨ����ͭ�����нᾧˮ������ʵ��ʱ������ʱ�����δ��ȫ��� |
| C���к͵ζ�ʱ���Ӵ���Һǰ��ƿ��������ˮ |
| D���ⶨ1mol��������IJ����У���Ӧ������δ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| n |
| 2 |
| 3n |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
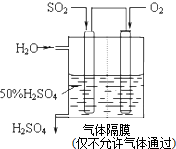
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
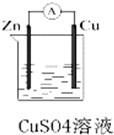 ij��ѧ��ȤС��������ͼ��ʾԭ���װ�ý���ʵ�飬��ش��������⣺
ij��ѧ��ȤС��������ͼ��ʾԭ���װ�ý���ʵ�飬��ش��������⣺�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com