
下列说法正确的是
A.强氧化剂与强还原剂不一定能发生氧化还原反应
B.含最高价元素的化合物一定只表现强氧化性
C.阳离子只有氧化性,阴离子只有还原性
D.发生化学反应时,失电子越多的金属原子,还原能力越强
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学燃烧热与盖斯定律(解析版) 题型:选择题
下列说法正确的是
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.H2SO4(aq)+Ba(OH)2(aq)==BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氮气、氧化物及硝酸(解析版) 题型:实验题
请分析回答某同学在探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铜反应的实验中发现的有关问题。
Ⅰ.探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质
(1)分别向盛有等量铜片的四支试管中加入等体积的浓硫酸、稀硫酸、浓硝酸、稀硝酸,实验结果记录如下表:
| 酸 | 实验结果 |
a | 浓硫酸 | 加热后发生反应,产生无色刺激性气体 |
b | 稀硫酸 | 加热也不发生反应 |
c | 浓硝酸 | 不加热即发生反应,产生红棕色气体 |
d | 稀硝酸 | 微热发生反应,产生无色气体 |
①由上表中实验结果,四种酸的氧化性由强到弱的顺序是 。
②由上表可知,铜与稀硫酸在加热条件下不反应,但若同时通入O2,铜片能逐渐溶解,溶液变为蓝色。写出该反应的化学方程式: 。
(2)先将铜与浓硫酸反应产生的气体X持续通入如图所示装置中,一段时间后再将铜与浓硝酸产生的气体Y也持续通入该装置中,则整个过程中可观察到的现象包括 (填字母)。

A.通入X气体后产生白色沉淀
B.通入X气体后溶液无明显现象
C.通入Y气体后产生沉淀
D.通入Y气体后沉淀溶解
E.通入Y气体后溶液中无明显现象
由此可得到的结论是 (填字母)。
A.硝酸的酸性比硫酸强
B.H2SO3的酸性比盐酸强
C.HNO3能氧化H2SO3(或SO2)
D.BaSO4既不溶于水也不溶于HNO3溶液
Ⅱ.如图是某同学探究铜与稀硝酸反应的还原产物的实验装置图,请回答下列问题:
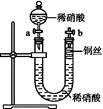
(1)写出铜与稀硝酸反应的离子方程式: 。
(2)已知装置气密性良好,请简述利用该装置证明铜与稀硝酸反应生成的气体产物是NO的操作过程: 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原规律(解析版) 题型:选择题
已知氧化性:Cl2>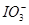 >Fe3+>I2,以下实验的结论或实验的预测合理的是
>Fe3+>I2,以下实验的结论或实验的预测合理的是
A.往溶液中加入过量的氯水再加淀粉,振荡不出现蓝色,说明没有I-
B.向FeCl2溶液中滴加碘水,所得溶液中加入KSCN溶液将呈红色
C.向淀粉碘化钾试纸上滴白醋和加碘盐的溶液,试纸变蓝,说明加碘盐中有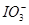
D.往FeI2溶液中滴加少量氯水,溶液变成棕黄色,说明有Fe3+生成
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原概念(解析版) 题型:选择题
火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2→Cu2S+2FeS+SO2下列说法正确的是
A.SO2只是氧化产物
B.CuFeS2仅作还原剂,硫元素被氧化
C.每生成1 molCu2S,有4mol硫被氧化
D.每转移1.2 mol电子,有0.2 mol硫被氧化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧化还原反应方程式的配平及相关计算(解析版) 题型:填空题
已知:氧化性:KMnO4>HNO3;Bi位于周期表中ⅤA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
①向其中加入适量的NaBiO3,溶液变为紫红色。②继续滴加适量H2O2,紫红色褪去,并有气泡产生。③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式: 。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是 。
(4)若实验②放出了336 mL气体(标准状况),则反应①被氧化的Mn(NO3)2为 mol。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学氧、硫及其化合物主要性质(解析版) 题型:选择题
下列气体:①NH3 ②NO2 ③NO ④O2 ⑤SO2中,适于用下图装置制取和收集的气体是

A.①②B.②③C.③④D.②⑤
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学无机物性质及应用(金属)(解析版) 题型:选择题
下列方法不能用于鉴别Na2CO3和NaHCO3固体的是
A.分别加热两种固体,将放出的气体通入澄清石灰水
B.分别取两种固体溶于水,滴加Ba(OH)2溶液,观察是否生成沉淀
C.分别取两种固体各1 g,滴入几滴水振荡,用手触摸试管底部
D.分别取等质量的固体与足量稀盐酸充分反应,加热、蒸干、灼烧称重
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com