
| A.Li+中含有的中子数与电子数之比为2︰1 |
| B.在C2H6分子中极性共价键与非极性共价键数之比为6︰1 |
| C.常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1 |
| D.5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1 |
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案科目:高中化学 来源:不详 题型:单选题
| A.Zn+H2SO4═ZnSO4+H2↑ | ||||
B.2KClO3
| ||||
C.S+O2
| ||||
D.CH4+2O2
|
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.60 ml | B.45 ml. | C.30 mL | D.15mL |
查看答案和解析>>
科目:高中化学 来源:不详 题型:推断题
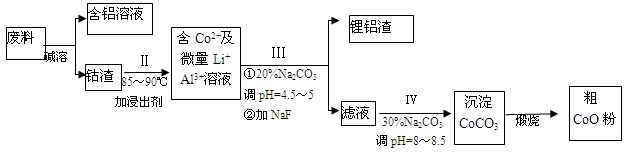
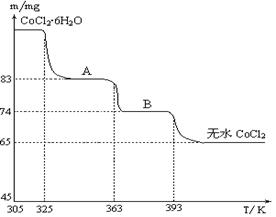
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1:6 |
| B.2:15 |
| C.2:11 |
| D.1:7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②④⑤ | B.①③⑤ |
| C.①②③④ | D.只有①③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。
Cu2O+H2↑,则石墨应与电源的________极相连,铜电极上的电极反应式为________;电解过程中,阴极区周围溶液pH________(填“变大”、“变小”或“不变”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Cu与Cu2O的物质的量之比为2∶1 |
| B.硝酸的物质的量浓度为2.6 mol·L-1 |
| C.产生的NO在标准状况下的体积为4.48 L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com