(1)1个N2分子的质量是 g;
(2)如果1gH2O中含有X个H原子,则阿伏加德罗常数可表示为 mol-1;
(3)要使每100个水分子中含1个Na+,则应将0.1mol的NaOH加入 g水中;
(4)配制100ml 1mol?L-1的稀硫酸,则需用量筒量18mol?L-1的浓硫酸 ml;
(5)将MgSO4和Al2(SO4)3溶液等体积混合后,铝离子的物质的量浓度为0.1mol?L-1,硫酸根离子的浓度为0.3mol?L-1,则原硫酸镁溶液中镁离子的浓度为 mol?L-1.
【答案】
分析:根据n=

=

计算(1)(2)(3)题;
根据溶液稀释前后溶质的物质的量不变计算(4)题;
根据溶液的电中性原则计算镁离子浓度.
解答:解:(1)根据n=

=

可知:1个N
2分子的质量是m=

=

g,故答案为:

;
(2)根据n=

=

可知,如果1gH
2O中含有X个H原子,则阿伏加德罗常数可表示为:N
A=

=

=9X,故答案为:9X;
(3)根据n=

可知,物质的分子数之比等于物质的量之比,
每100个水分子中含1个Na
+,则每100mol水分子中含有1molNa
+,则应将0.1mol的NaOH加入10mol水中,
质量为:10mol×18g/mol=180g,故答案为:180;
(4)设需要浓硫酸的体积为V,
溶液稀释前后溶质的物质的量不变,
则有:0.1L×1mol/L=V×18mol/L,
V=
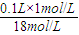
=0.0056L,即5.6ml,故答案为:5.6;
(5)任何溶液都呈电中性,则混合后的溶液中:
2c(Mg
2+)+3c(Al
3+)=2c(SO
42-),c(Mg
2+)=

=0.15mol/L,
所以原硫酸镁溶液中镁离子的浓度为2×0.15mol/L=0.3mol/L,故答案为:0.3.
点评:本题考查物质的量、物质的量浓度以及阿伏加德罗常数的计算,题目难度不大,注意有关计算公式的运用.

 =
= 计算(1)(2)(3)题;
计算(1)(2)(3)题; =
= 可知:1个N2分子的质量是m=
可知:1个N2分子的质量是m= =
= g,故答案为:
g,故答案为: ;
; =
= 可知,如果1gH2O中含有X个H原子,则阿伏加德罗常数可表示为:NA=
可知,如果1gH2O中含有X个H原子,则阿伏加德罗常数可表示为:NA= =
= =9X,故答案为:9X;
=9X,故答案为:9X; 可知,物质的分子数之比等于物质的量之比,
可知,物质的分子数之比等于物质的量之比,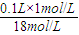 =0.0056L,即5.6ml,故答案为:5.6;
=0.0056L,即5.6ml,故答案为:5.6; =0.15mol/L,
=0.15mol/L,
