
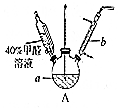
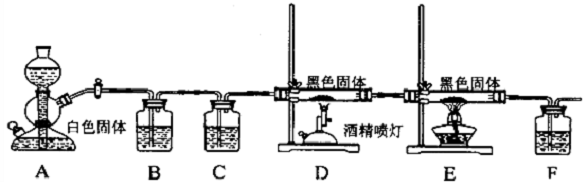
 甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.
甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发.为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究.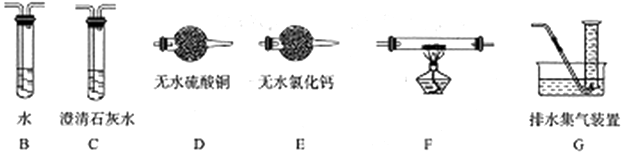
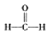 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$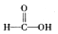 $\stackrel{被氧化}{→}$
$\stackrel{被氧化}{→}$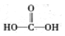 .设计实验证明a中甲醛的碳元素未被氧化成+4价.
.设计实验证明a中甲醛的碳元素未被氧化成+4价.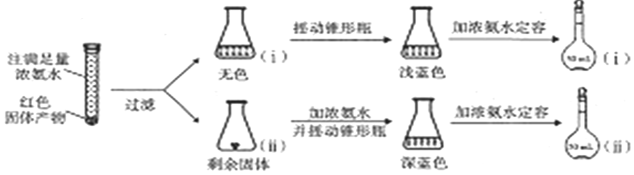
分析 (1)①仪器b为球形冷凝管,主要是冷凝回流反应物;
②甲醛具有还原性,和新制氢氧化铜加热反应生成氧化亚铜红色沉淀;
(2)为确认气体产物中含H2不含CO,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体.据此设计实验验证;
(4)①氧化亚铜加入浓氨水得到无色溶液,在空气中变化为蓝色;
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液是铜、氧气和一水合氨溶液反应生成深蓝色络离子;
③反应现象和元素守恒得到固体物质组成为氧化亚铜和铜,将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近说明浓度相同;
解答 解:(1)①仪器b为球形冷凝管,主要是冷凝回流反应物,
故答案为:球形冷静管;冷凝回流;
②能说明甲醛具有还原性的实验现象是和新制氢氧化铜加热反应生成氧化亚铜红色沉淀A中出现红色物质(或A中出现棕色物质),
故答案为:A中出现红色物质(或A中出现棕色物质);
(2)为确认气体产物中含H2不含CO,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体,依次连接的合理顺序为ABEFDCG,装置B的作用是吸收甲醛蒸气,防止其干扰后续检验,
故答案为:EFDC;吸收甲醛蒸气,防止其干扰后续检验;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体.设计实验证明a中甲醛的碳元素未被氧化成+4价的方法为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价,
故答案为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价;
(4)①氧化亚铜加入浓氨水得到无色溶液,在空气中变化为蓝色,摇动锥形瓶ⅰ的目的是有利于溶液与空气中的氧气接触,
故答案为:有利于溶液与空气中的氧气接触;
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液是铜、氧气和一水合氨溶液反应生成深蓝色络离子,反应的离子方程式为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O,
故答案为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
③将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近.由此可知固体产物的组成及物质的量之比约为n(Cu2O):n(Cu)=1:200,
故答案为:1:200;
点评 本题考查了物质组成的实验探究、物质性质、反应现象、实验关系分析判断,掌握基础是解题关键,题目难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 15种 | B. | 16种 | C. | 17种 | D. | 18种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 医用酒精的浓度通常为95% | |
| B. | Y(C2H5OH),W(C2H5ONa)可通过消去反应由Y得到W | |
| C. | 实验室中提纯混有少量乙酸的乙醇,可采用先加生石灰,过滤后再蒸馏的方法 | |
| D. | 向无水乙醇中加入浓H2SO4,加热至170℃,产生的气体通入酸性KMnO4溶液,紫红色褪去,使溶液褪色的气体只是乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A.配制0.10mol/LNaOH溶液 | B.观察Fe(OH)2的生成 | C.萃取碘水中的I2分出水层后的操作 | D.记录滴定终点读数为12.20mL |
 |  | 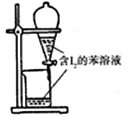 | 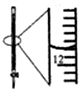 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
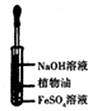
| 实验1 | 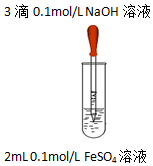 | 实验现象 |
| 液面上方产生白色絮状沉淀,迅速变为灰绿色,振荡,试管壁上有红褐色沉淀生成. |
| 试管中10mL NaOH溶液 | 滴加 FeSO4溶液 | 实验现象 | |
| 实验2 | 6mol/L NaOH溶液 | 0.2mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有少量灰绿色),沉淀下沉后,大部分灰绿色变为白色沉淀 |
| 实验3 | 6mol/L NaOH溶液 | 0.1mol/L FeSO4溶液 | 产生悬浮于液面的白色沉淀(带有极少量灰绿色),沉淀下沉后,底部都为白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com