
���������������Ƚ������ⷽ������������������������������Ӧϵͳͬʱͨ����顢������ˮ��������������Ҫ��ѧ��Ӧ�У�
��Ӧ ���� | ��ѧ����ʽ | �ʱ��H ��kJ/mol�� | ����Ӧ���Ea ��kJ/mol�� |
���� ����[ | CH4��g����2O2��g����CO2��g����2H2O��g�� | ��802��6 | 125��6 |
CH4��g����O2��g����CO2��g����2H2��g�� | ��322��0 | 172��5 | |
���� ���� | CH4��g����H2O��g����CO��g����3H2��g�� | 206��2 | 240��1 |
CH4��g����2H2O��g����CO2��g����4H2��g�� | 165��0 | 243��9 |
�ش��������⣺
��1����ӦCO��g����H2O��g����CO2��g����H2��g���ġ�H= kJ/mol��
��2���ڳ�ʼ��,�������������ķ�Ӧ���� ���������ķ�Ӧ���ʣ�����ڡ�С�ڻ���ڣ���
��3���������෴Ӧ����ij��֣�B����ƽ��ѹǿ��PB���������ʵ���Ũ�ȣ�cB��Ҳ�ɱ�ʾƽ�ⳣ��������KP������ӦCH4��g����H2O��g�� CO��g����3H2��g��KP�ı���ʽΪ �������¶ȵ����ߣ���ƽ�ⳣ�� �����������С�����䡱����
CO��g����3H2��g��KP�ı���ʽΪ �������¶ȵ����ߣ���ƽ�ⳣ�� �����������С�����䡱����
��4���������Ƕȷ������������������������Ƚ�֮������ ��
��5����ijһ�������ϱȵ�����£��¶ȡ�ѹǿ��H2��CO���ʵ���������Ӱ������ͼ��
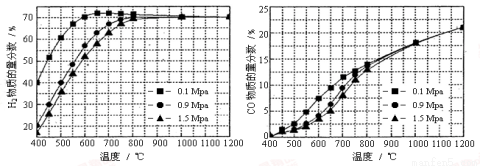
����Ҫ�ﵽH2���ʵ�������>65%��CO�����ʵ�������<10%����������������ʵ��� ��
A��600�棬0.9Mpa B��700�棬0.9Mpa C��800�棬1.5Mpa D��1000�棬1.5MPa
�ڻ���600�棬0��1Mpa�����£�ϵͳ��H2���ʵ��������淴Ӧʱ�䣨�ӳ��½��Ͽ�ʼ��ʱ���ı仯����ʾ��ͼ��
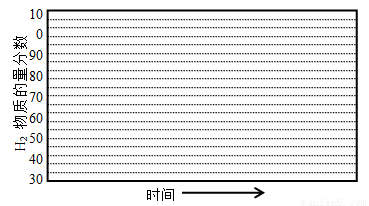
��6������������������������յ���H2���ʵ����������ͣ�ԭ���� ��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�꺣�ϼλ���ѧ�߶����������ƻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
ijȲ����������õ�2-�����飬��Ȳ����
A��2-��-1-��Ȳ B��2-��-3-��Ȳ C��3-��-1-��Ȳ D��3-��-2-��Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ�ʯ����ѧ�߶�4���¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
ҽ�����̷�(FeSO4•7H2O)������ȱ����ƶѪ����Чҩ��ij��ѧ��ȤС����̷����������µ�̽����
���Ʊ���Ʒ��
��С���ɷ���м(����������ͭ��������������)������ͼ��ʾװ���Ʊ� FeSO4 •7H2O���壬�������£�
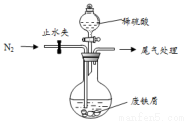
��1��Ԥ�������Ƚ�����м���뵽���� Na2CO3��Һ��ϴ�ӣ�Ŀ����__________ ��Ȼ����м��ˮϴ�� 2��3 �顣
��2����ϴ�Ӻ�ķ���м���뵽Բ����ƿ�У�������ͨ��N2
��3���ټ�������ϡ���ᣬ�����¶� 50�桫80��֮�䣬��ַ�Ӧ��Բ����ƿ��ʣ��Ĺ���Ϊ__________ ��ʵ���ҳ������軯����Һ���鷴Ӧ���ɵ�Fe2+��д���÷�Ӧ�����ӷ�Ӧ����ʽ��______________��
��4����ȡ��Ʒ�������裨3���з�Ӧ��Ļ�����м�����������ˮ�����ȹ��ˣ���ȴ�ᾧ���˳����壬��������ˮϴ�� 2��3 �Σ�������ֽ���������ɣ��ܱձ��档
���ⶨFeSO4 •7H2O ������
��1����ȡ������Ʒ 10.0g������������ϡ�����У���� 100mL ��Һ��ȷ��ȡ 25.00mL ��Һ������ƿ�У��� 0.1000mol/L KMnO4����Һ�ζ��ζ�3�Σ�ƽ������ 10.00mL��Һ������Ʒ�� FeSO4 •7H2O ����������Ϊ________ ��(��֪ Mr(FeSO4 •7H2O)=278)��
��2�����������ƫС����������ڶ���ʱ________(����ӡ������ӡ�)������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ�ʯ����ѧ�߶�4���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��ͼ��ʾΪijԭ��صĽṹʾ��ͼ������˵������ȷ����(������װ���ñ���KCl ��Һ���������ɵĶ���)
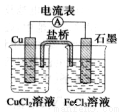
A����ԭ��ص��ܷ�ӦʽΪ2Fe3+ + Cu = Cu2++ 2Fe2+
B���õ�ع���ʱ��������K+��ʯī�缫�����ƶ�
C�����ô˵�ص�ⱥ��ʳ��ˮ��ȡCl2����ͭ�缫����������6.4 gʱ���������������Ϊ2.24 L
D����ع��������У�������ͭ�缫��������������ʯī�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ���Ĵ��ɶ�ʯ����ѧ�߶�4���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵����ȷ����
A��ú�ĸ����ú��Һ�����������仯
B�������п�������ɱ������壬�Ʋ����������ʧȥ��������
C�����ڹ��ۼ����з����ԣ����ۻ��������γɾ���ʱ����ȡ�����ܶѻ���
D����Ӧ�����²����Է����У���÷�Ӧ�ġ�H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʯ��ɽ���и�������ģ���ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����л���ͬ���칹����Ŀ�жϴ������
ѡ�� | �л��� | ͬ���칹����Ŀ |
A | ����ʽΪC5H12 | 3 |
B | ����ʽΪC5H10����ʹ������Ȼ�̼��Һ��ɫ | 5 |
C | ����ʽΪC4H10O������Na��Ӧ�������� | 4 |
D | ����ʽΪC4H8O2������NaHCO3��Ӧ | 3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ���������һ��ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ������
�о�CO2�����öԴٽ���̼���Ĺ���������Ҫ���塣
��1����CO2�뽹̿��������CO��CO�����������ȡ�
��֪����Fe2O3(s) + 3C(ʯī) = 2Fe(s) + 3CO(g) ��H 1 = +489.0 kJ��mol��1
��C(ʯī) +CO2(g) = 2CO(g) ��H 2 = +172.5 kJ��mol��1
��CO��ԭFe2O3(s)���Ȼ�ѧ����ʽΪ ��
��2��������̼�ϳɼ״���̼���ŵ��·���CO2ת��Ϊ�״����Ȼ�ѧ����ʽΪ��
CO2(g) +3H2(g) CH3OH(g) +H2O(g) ��H
CH3OH(g) +H2O(g) ��H
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪK= ��
��ȡһ�����CO2��H2�Ļ�����壨���ʵ���֮��Ϊ1��3������������ܱ������У�����������Ӧ����Ӧ�����в�ü״������������(CH3OH)�뷴Ӧ�¶�T�Ĺ�ϵ��ͼ1��ʾ����÷�Ӧ�Ħ�H 0���>������<����������
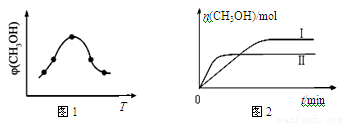
�������ֲ�ͬ�����·�����Ӧ�����CH3OH�����ʵ�����ʱ��仯��ͼ2��ʾ�����ߢ��Ӧ��ƽ�ⳣ����С��ϵΪK�� K��(�>������<������)���жϵ����� ��
��3����CO2Ϊԭ�ϻ����Ժϳɶ������ʡ�
�ٹ�ҵ������[CO(NH2)2]��CO2��NH3��һ�������ºϳɣ��䷴Ӧ����ʽΪ ����ʼ��̼��=3���з�Ӧ����ƽ��ʱCO2��ת����Ϊ60������NH3��ƽ��ת����Ϊ ��
�ڽ�����CO2ͨ�뱥�Ͱ�ˮ�пɵõ���NH4HCO3����֪������һˮ�ϰ�Kb=1.8��10��5��̼��һ�����볣��Kb=4.3��10��7����NH4HCO3��Һ�� ������ԡ��������ԡ��������ԡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016������ʡ�������ߴ�ģ�����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
�����й����ʽṹ��˵����ȷ����
A�����Ӳ������ԭ�ӵİ뾶һ�����ڵ��Ӳ����ٵ�ԭ�ӵİ뾶
B��P4S3�����и�ԭ�ӵ��������Ѵﵽ��8�����ȶ��ṹ��������й��ۼ���ĿΪ9��
C��H2SO3����ǿ��H2CO3�����Էǽ�����S����C
D����ͬԭ���γɵĹ��ۼ�һ���Ǽ��Լ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�캣��ʡ�����ھŴ��¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���л�ѧ�����ģ�ͱ�����ȷ����
A���Ҵ������ģ��Ϊ��
B��������ĽṹʽΪ��HһC1һO
C�����۵Ľṹ��ʽΪ��[C6H12O6]n
D����ϩ�ĵ���ʽΪ��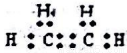
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com