
 SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.
SiCl4在室温下为无色液体,易挥发,有强烈的刺激性.把SiCl4先转化为SiHCl3,再经氢气还原生成高纯硅.分析 (1)反应物为SiHCl3和H2,生成物Si和HCl,可很容易得到正确的方程式.
(2)运用盖斯定律,利用反应ⅰ的逆反应且系数乘3再加上反应ⅱ的正反应且系数要乘以4,即可计算出反应的热效应为-117kJ.mol-1.
(3)从图4可以看出最适宜温度应该是500℃,刚开始SiCl4转化率随温度升高的原因是尚未达到平衡状态,温度高反应速率快,故转化率增大.
(4)①根据速率的计算公式,可先计算出SiHCl3的速率,再结合化学计量数与速率之间的关系,SiCl4的速度应该是SiHCl3的四分之三.
②同结合概念写出平衡常数表达式,温度升高平衡逆向移动故K值减小.
③平衡时SiHCl3的物质量为0.4mol,也即反应中的变化量为0,4mol,所以H2的变化量为0.2mol,再加上平衡时的2mol,起始时H2的量应该为2.2mol,所以体积为49.28L.
④若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),等效为压强增大一倍,平衡向正反应方向移动.
⑤平衡后,将容器的体积压缩为1L,压强增大,平衡向正反应方向移动,若平衡不移动,此时氢气浓度为极大值,平衡移动不能消除氢气浓度增大,到达新平衡时的浓度仍大于原平衡时的浓度.
解答 解:(1)高温条件下,SiHCl3与氢气反应生成Si与HCl,反应方程式为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl.
故答案为:SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl;
(2)已知:(i)Si(s)+4HCl(g)=SiCl4(g)+2H2(g)△H=-241kJ.mol-1
(ii)Si(s)+3HCl(g)=SiHCl3(g)+H2(g)△H=-210kJ.mol-1
则SiCl4转化为SiCl3的反应(iii):
(ii)×4-(i)×3可得:3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g),故△H=4×(-210kJ.mol-1
)-3×(-241kJ.mol-1)=-117kJ.mol-1.
故答案为:-117KJ.mol-1.
(3)由图可知,四氯化碳的转化率在500℃达最高,故最适宜的温度为500℃;开始反应未到达平衡,温度升高反应速率加快,四氯化碳的转化率增大.
故答案为:500℃;反应未达到平衡,温度升高反应速率加快,SiCl4转化率增大.
(4)①6h后达到平衡,SiHCl3的物质量浓度为0.2mol•L-1,则v(SiHCl3)=$\frac{0.2mol/L}{6h}$=$\frac{1}{30}$mol/(L•h),速率之比等于其化学计量数之比,则v(SiCl4)=$\frac{3}{4}$v(SiHCl3)=$\frac{3}{4}$×$\frac{1}{30}$mol/(L•h)=0.025mol/(L•h);
故答案为:0.025mol/(L•h).
②3SiCl4(g)+2H2(g)+Si(s)?4SiHCl3(g)的平衡常数表达式k=$\frac{{c}^{4}(SiHC{l}_{3})}{{c}^{3}(SiC{l}_{4})•{c}^{2}({H}_{2})}$,该反应正反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小.
故答案为:$\frac{{c}^{4}(SiHC{l}_{3})}{{c}^{3}(SiC{l}_{4})•{c}^{2}({H}_{2})}$;减小.
③浓度变化量之比等于其化学计算之比,则H2的浓度变化量为0.2mol•L-1×$\frac{1}{2}$=0.1mol•L-1,故氢气的起始浓度为1mol•L-1+0.1mol•L-1=1.1mol•L-1,则通入氢气的物质的量为2L×1.1mol•L-1=2.2mol,标况下氢气的体积为2.2mol×22.4L/mol=49.28L.
故答案为:49.28L.
④若平衡后再向容器中充人与起始时等量的SiCl4和H2(假设Si足量),等效为压强增大一倍,平衡向正反应方向移动,有方程式可知1mol氢气反应时,混合气体总物质的量减小1mol,故到达新平衡时氢气的体积分数减小.
故答案为:减小.
⑤平衡后,将容器的体积压缩为1L,压强增大,平衡向正反应方向移动,若平衡不移动,此时氢气浓度为极大值为2×1mol•L-1=2mol•L-1,平衡移动不能消除氢气浓度增大,到达新平衡时的浓度仍大于原平衡时的浓度1mol.L-1,故再次达到平衡时,H2的物质的量浓度范围为:1mol•L-1<c(H2)<2mol•L-1.
故答案为:1mol/L<C(H2)<2mol/L.
点评 本题热化学反应及化学平衡 涉及盖斯定律的应用、化学平衡常数、平衡移动的方向判断及相关计算,另外还考查了勒夏特列原理的应用.题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | H2 SO4 | B. | CuSO4 | C. | Na2 SO4 | D. | NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
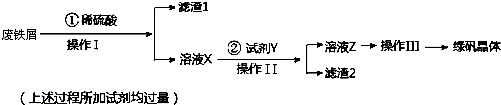
| 氢氧化钠质量(g) | 氯化钠质量(g) | |
| ① | 2.40 | 3.51 |
| ② | 2.32 | 2.34 |
| ③ | 3.48 | 3.51 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1﹕2﹕3 | B. | 1﹕1﹕1 | C. | 2﹕3﹕6 | D. | 3﹕2﹕1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在前50 s的平均速率为v(PCl3)=0.0016mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11mol•L-1,则反应的△H>0 | |
| C. | 相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆) | |
| D. | 相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
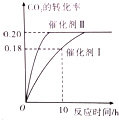 已知CO2可生成绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃时密闭容器中,当c(CO2)=1.00mol/L、c(H2)=1.60mol/L开始反应,结果如图所示,回答下列问题:
已知CO2可生成绿色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H<0 300℃时密闭容器中,当c(CO2)=1.00mol/L、c(H2)=1.60mol/L开始反应,结果如图所示,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | ① | ||||||
| 二 | ② | ③ | ④ | ||||
| 三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com