��ѧ��ѧ������������������ʹٽ���ᷢչ������Ҫ���ã�����˵����ȷ����
���ø�Ч�뵼��������ȡ���׳�ƣ������ڽ��ܼ���
���з���ȫ��Чҩ������ڵ������༲��
�۹淶ʳƷ���Ӽ������Ϳ�ѧʹ�ã������ڱ������彡����������ȫ
���ƹ�����������������ļ���������Դ������,�����ڻ�����������Դ�ij������
�ݳ��ڰ�װ���ڷ�����ʯ�������ڷ�ֹ�±��ȸ�֬ʳƷ�������ʣ�
- A.
�٢ڢ�
- B.
�ڢܢ�
- C.
�٢ۢ�
- D.
�٢ڢۢ�
D
������������ڰ�װ���ڷ�����ʯ�ң��������ˮ�������ڷ�ֹ�±����ܳ����ܴ���
���㣺����STS�л��������й����⡣
��ϰ��ϵ�д�
���ϰ��
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
NA��ʾ�����ӵ�������ֵ������˵����ȷ����

- A.
5.6 g������0.1mol�����г��ȼ�գ�ת�Ƶ�����Ϊ0.3NA
- B.
12.5mL 16mol��L-1Ũ����������ͭ��Ӧ��ת�Ƶ�����Ϊ0.2NA
- C.
7.8g Na2S��Na2O2�Ļ�����к��е���������������0.1NA
- D.
0.5mol�ۻƣ�As4S4����֪As��Nͬ����,�ṹ����ͼ������NA��S��S��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
�±����������Ȼ����뵥��B���۷е㣬�����ж�����ȷ����
| | NaCl | MgCl2 | AlCl3 | SiCl4 | ����B |
| �۵㣨�棩 | 801 | 714 | 190 | ��70 | 2300 |
| �е㣨�棩 | 1413 | 1412 | 180 | 57 | 2500 |
- A.
SiCl4��ԭ�Ӿ���
- B.
����B������ԭ�Ӿ���
- C.
AlCl3�ڼ���ʱ��������
- D.
NaCl��MgCl2�������ۻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
���ж��йػ�ѧ��Ӧ���̻�ʵ������Ľ����У���ȷ����
- A.
NH3��ˮ��Һ���Ե��磬˵��NH3�ǵ����[��Դ:Zxxk.Com]
- B.
�ڸ��������£�C���û���SiO2�е�Si,˵��C��������ǿ��Si��[��Դ:ѧ��ơ���]
- C.
�ڵ��з�̪��Na2CO3��Һ�У�����CaCl2��Һ����Һ��ɫ��˵��CaCl2��Һ������
- D.
����۵⻯�ص���Һ�м�����ˮ����Һ��Ϊ��ɫ��˵��Br2��������ǿ��I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
����ʵ�����������������
- A.
��ϡ�����еμӷ�̪��Һ����Һ���ɫ
- B.
��������Һ�еμӵ�ˮ����Һ����ɫ
- C.
H2��C12��ȼ�շ�����ɫ����
- D.
��S02ͨ��Ʒ����Һ����Һ��ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
������������ʽ����ƽ�������(N2H4)��Ϊȼ�ϣ�NO2��Ϊ����������Ӧ����N2��ˮ��������֪��N2(g) + 2O2(g) ��2NO2(g)�� ��H��+67.7 kJ/mol
N2H4(g) + O2(g) �� N2(g) + 2H2O(g)�� ��H��-534 kJ/mol
���й����º�NO2��Ӧ���Ȼ�ѧ����ʽ�У���ȷ����
- A.
2N2H4(g) + 2NO2(g) �� 3N2(g) + 4H2O(l)����H��-1135.7 kJ/mol
- B.
N2H4(g) + NO2(g) �� 3/2N2(g) + 2H2O(g)����H��-567.85 kJ/mol
- C.
N2H4(g) + NO2(g) �� 3/2N2(g) + 2H2O(l)����H��-1135.7 kJ/mol
- D.
2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g)����H��+1135.7 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
���ǰ�ʳƷ��Ϊ��ɫʳƷ����ɫʳƷ����ɫʳƷ�ȣ���ɫֲ��ͨ���������ת����ʳƷ����ɫʳƷ�������ṩ��ʳƷ����ɫʳƷ��ͨ������͵�ʳƷ�а�ɫʳƷ���������ڰ�ɫʳƷ����
- A.
ʳ��
- B.
���
- C.
����
- D.
����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
�����ܹ��ṩij����ʽ�����������ʣ����������˶���ͳ��Ϊ��Դ������Դ�������ͼ����ͼ��ʾ��������Դѡ���У�ȫ������ͼ����Ӱ���ֵ���Դ��
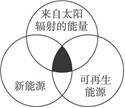
- A.
ú̿��ʯ�͡���ϫ��
- B.
ˮ�ܡ������ܡ���Ȼ��
- C.
̫���ܡ����ܡ�����
- D.
�����ܡ������ܡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ
��Դ��
���ͣ���ѡ��
��0.2mol NaOH����Һ��ͨ��һ������H2S���壬��ַ�Ӧ���õ���ҺС�ļ�ѹ���ɣ��ù���7.9g�������ˮ��һ�����е�����Ϊ
- A.
Na2S��NaHS
- B.
Na2S��NaOH
- C.
NaHS
- D.
Na2S
�鿴�𰸺ͽ���>>



