
 .
.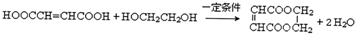 .
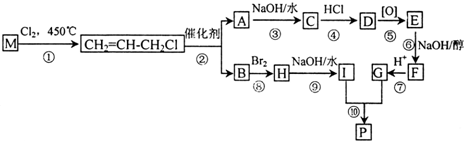
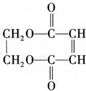
. 分析 M是石油裂解气的重要成分,与氯气发生取代反应生成CH2=CHCH2Cl,则M为CH2=CHCH3.由反应信息可知,CH2=CHCH2Cl在催化剂条件下生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2.B与溴发生加成反应生成H,H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I,I为HOCH2-CH2OH.A在氢氧化钠水溶液、加热条件下发生反应生成C,C为HOCH2CH=CHCH2OH,C生成D是C与HCl的加成反应,故D为HOCH2CH2CHClCH2OH,D发生氧化反应生成E,E发生消去反应生成F,F酸化得到G,而G与I发生酯化反应生成环酯P,则E为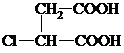
 .
.
解答 解:M是石油裂解气的重要成分,与氯气发生取代反应生成CH2=CHCH2Cl,则M为CH2=CHCH3.由反应信息可知,CH2=CHCH2Cl在催化剂条件下生成CH2=CH2、ClCH2CH=CHCH2Cl,A在氢氧化钠水溶液、加热条件下发生反应,故A为ClCH2CH=CHCH2Cl,B为CH2=CH2.B与溴发生加成反应生成H,H为BrCH2CH2Br,H在氢氧化钠水溶液、加热条件下发生取代反应生成I,I为HOCH2-CH2OH.A在氢氧化钠水溶液、加热条件下发生反应生成C,C为HOCH2CH=CHCH2OH,C生成D是C与HCl的加成反应,故D为HOCH2CH2CHClCH2OH,D发生氧化反应生成E,E发生消去反应生成F,F酸化得到G,而G与I发生酯化反应生成环酯P,则E为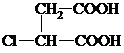
 .
.
(1)M为CH2=CHCH3,M的名称是丙烯,A为ClCH2CH=CHCH2Cl,A含有的官能团名称是碳碳双键、氯原子,
故答案为:丙烯;碳碳双键、氯原子;
(2)①的反应类型是取代反应,⑥的反应类型是消去反应,
故答案为:取代反应;消去反应;
(3)C的结构简式为HOCH2CH=CHCH2OH,由C→G的过程中步骤④、⑥的目的是:保护分子中碳碳双键不被氧化,
故答案为:HOCH2CH=CHCH2OH;保护分子中碳碳双键不被氧化;
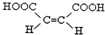
(4)G为HOOC-CH=CH-COOH,碳碳双键、碳氧双键均为平面结构,旋转碳碳双键,平面可以共面,旋转C-O单键可以使羟基中H原子处于平面内,分子中的12个原子都可以共面,其顺式结构式为 ,
,
故答案为:12; ;
;
(5)D为HOCH2CH2CHClCH2OH,D的同分异构体中Cl原子位于端头碳原子上,且羟基连在不同的碳原子上的有ClCH2CH(OH)CH2CH2OH、ClCH2CH2CH(OH)CH2OH、ClCH(OH)CH2CH2CH2OH、ClCH2CH(OH)CH(OH)CH3、ClCH(OH)CH2CH(OH)CH3、ClCH(OH)CH(OH)CH2CH3、ClCH(OH)C(CH3)2OH、ClCH(OH)CH(CH3)CH2OH、ClCH2C(OH)(CH3)CH2OH、ClCH2CH(CH2OH)2,共10种,其中核磁共振氢谱为4组峰,且峰面积比为4:2:2:1的为 ClCH2CH(CH2OH)2,
故答案为:10;ClCH2CH(CH2OH)2;
(6)由I和G在一定条件下制取环酯P的化学方程式为: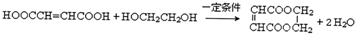 ,
,
故答案为: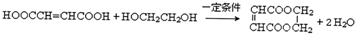 .
.
点评 本题考查有机物推断,侧重考查学生分析推断能力及信息获取利用能力,根据某些物质结构简式、反应条件、题给信息结合有机物官能团及其性质进行推断,难点是(5)题同分异构体种类判断,注意限制性条件,题目难度中等.


科目:高中化学 来源: 题型:解答题
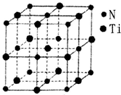 金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值.请回答下列问题:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ•mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 241 | B. | 146 | C. | 95 | D. | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z的热稳定性逐渐增强 | |
| B. | A、B、C、D只能形成5种单质 | |
| C. | A、B的氧化物的水化物的酸性逐渐增强 | |
| D. | 由B、C、D三种元素组成的化合物中只能形成共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 现象或操作 | 解释或结论 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 在0.1mol•L-1的CH3COONa溶液中,加2滴酚酞显浅红色,微热,溶液颜色加深 | 盐类水解反应是吸热反应 |
| C | 向少量火柴头的浸泡溶液中滴加AgNO3、HNO3和NaNO2混合溶液后,产生白色沉淀 | 火柴头里含有氯元素 |
| D | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是馏出物的沸点 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgSO4溶液与Ba(OH)2溶液混合:Ba2++SO42-=BaSO4↓ | |
| B. | 0.3 mol FeBr2与0.4 mol Cl2在溶液中反应:8Cl2+6Fe2++10Br-=6Fe3++16Cl-+5Br2 | |
| C. | Cu与稀HNO3反应:Cu+4H++2NO3-=Cu2++2NO↑+2H2O | |
| D. | AgCl固体溶于足量氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
Li2CO3+Li2SiO3;该反应为放(填“吸”或者“放”)热反应,原因是升高温度,平衡向逆向进行,说明逆反应为吸热反应,所以正反应为放热反应.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年重庆市高一上10月月考化学试卷(解析版) 题型:选择题
绿色植物是空气天然的“净化器”,研究发现,10000m2柳杉每月可以吸收160kgSO2,则100 m2柳杉每月吸收的SO2的物质的量为
A.2.5mol B.5mol C.25mol D.250mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com