
 甲、乙两池电极材料如图所示,请按要求回答下列问题:
甲、乙两池电极材料如图所示,请按要求回答下列问题:
| ||
| ||
| ||


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
 甲、乙两池电极材料如图所示.
甲、乙两池电极材料如图所示.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)甲、乙两池电极材料如图所示,请按要求回答下列问题:
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后: ①有红色物质析出的是甲池中的____ 棒(铁、碳);
②乙池碳极上电极反应属于___________(填氧化反应、还原反应)。
③乙池中阳极上发生的电极反应方程式是 _________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式 。
②甲池中碳极上电极反应方程式是 。
③若乙池中饱和NaCl溶液100 mL一段时间后在阴极得到112 mL(标准状况)H2,此时乙池溶液的(体积变化忽略不计)pH为__________
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:①阳电极的材料是____________
②阴极反应式是 。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源:2010—2011学年黑龙江省大庆实验中学高二上学期期末考试化学试卷 题型:填空题
(10分)甲、乙两池电极材料如图所示,请按要求回答下列问题: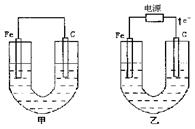
|
查看答案和解析>>
科目:高中化学 来源:2012届黑龙江省高二上学期期末考试化学试卷 题型:填空题
(10分)甲、乙两池电极材料如图所示,请按要求回答下列问题:
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后: ①有红色物质析出的是甲池中的____ 棒(铁、碳);
②乙池碳极上电极反应属于___________(填氧化反应、还原反应)。
③乙池中阳极上发生的电极反应方程式是 _________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式 。
②甲池中碳极上电极反应方程式是 。
③若乙池中饱和NaCl溶液100 mL一段时间后在阴极得到112 mL(标准状况)H2,此时乙池溶液的(体积变化忽略不计)pH为__________
(3)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则:①阳电极的材料是____________
②阴极反应式是 。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com