
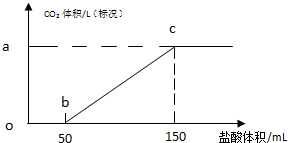
���� ��1����һ��̼���ƺ�HCl��Ӧ����NaHCO3��NaCl��û���������ɣ�
��2��50-100mLHClʱ������ӦNaHCO3+HCl=NaCl+CO2��+H2O�����������CO2֮���ϵʽ����CO2���ʵ������ٸ���V=nVm���������̼�����
��3������Na2CO3+HCl�TNaHCO3+NaCl��̼���ƺ�ϡ����֮���ϵʽ����Na2CO3����������Cԭ���غ�õ�̼����ת��Ϊ̼��������������ϣ�2���õ�ԭ����Һ��̼���������������Ӷ��õ�̼��������������
��� �⣺��1����һ��̼���ƺ�HCl��Ӧ����NaHCO3��NaCl��û���������ɣ��������������0-50mLʱû���������ɣ��ʴ�Ϊ��̼���������ᷴӦ����̼�����ƺ��Ȼ��ƣ�
��2��50-100mLHClʱ������ӦNaHCO3+HCl=NaCl+CO2��+H2O��
������CO2�����ʵ���Ϊn��CO2��
NaHCO3+HCl=NaCl+CO2��+H2O
1 1
1mol/L��0.10L n��CO2��
��ã�n��CO2��=0.10 mol
V��CO2��=0.10 mol��22.4 L/mol=2.24L
��a=2.24��
��3������Na2CO3+HCl�TNaHCO3+NaCl��̼���ƺ�ϡ����֮���ϵʽ��n��Na2CO3��=n��HCl��=1mol/L��0.05L=0.05mol����m��Na2CO3��=0.05mol��106g/mol=5.3g��
����Cԭ���غ�õ�̼����ת��Ϊ̼���������ʵ�����n��NaHCO3��=n��Na2CO3��=0.05mol��m��NaHCO3��=0.05mol��84g/mol=4.2g��
����Cԭ���غ��ԭ��m��NaHCO3��=n��CO2����M��NaHCO3��=0.1mol��84g/mol-4.2g=4.2g��
̼������������=$\frac{5.3g}{5.3g+4.2g}$��100%=55.8%��
�ʴ�Ϊ��55.8%��
���� ���⿼��������йؼ��㣬Ϊ��Ƶ���㣬���ؿ���ѧ������������������ȷ����������֮���ϵ�ǽⱾ��ؼ���ע��ԭ���غ��������ã���Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ���벹��������
���벹��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ��-C2H5OH | B�� | ����-KAl��SO4��2 | C�� | �մ�-NaHCO3 | D�� | ��ʯ��-CaO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.1 mol•L-1 Na2CO3��Һ�У�c��HCO3-��=2c��H2CO3��+c��H+��-c��OH-�� | |
| B�� | ���ʵ���Ũ����ȵ�Na2SO3��NaHSO3��Һ�У�3c��Na+��=2[c��HSO3-��+c��H2SO3��+c��SO32-��] | |
| C�� | ͬŨ�ȵ�������Һ�У���NH4HSO4 ��NH4Cl ��NH3•H2O��c��NH4+���ɴ�С��˳���ǣ��ڣ��٣��� | |
| D�� | �����£�Ũ�Ⱦ�Ϊ0.1mol/L NaA��HA��Һ��pH=8��c��HA����c��Na+����c��A-����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ø����pH��ֽ�ⶨNaClO��Һ��pH | |
| B�� | �����µ�ʯӢ�����н����ۻ��������ƹ����ʵ�� | |
| C�� | �÷�Һ©�������屽��ˮ�Ļ����ʱ���屽���¿ڷų���ˮ���Ͽڵ��� | |
| D�� | ��������������Ϊ10%������ͭ��Һ����ȷ��ȡ10 g����ͭ��������90 gˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ڵ���ƽ�⡢ˮ��ƽ��ͳ����ܽ�ƽ�� | |
| B�� | c��Na+��=c��Cl-����c��HCO3-����c��CO32-��=c��Ca2+�� | |
| C�� | c��Na+��+2c��Ca2+��=c��HCO3-��+2c��CO32-��+c��Cl-�� | |
| D�� | ��Ӧ�����ӷ���ʽ��2HCO3-+Ca2+�TCaCO3��+H2CO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AlCl3��Һ�Ͱ�ˮ | B�� | NaHCO3��Һ��Ca��OH��2��Һ | ||
| C�� | Na HCO3��Һ������ | D�� | ������Һ���ռ���Һ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com