
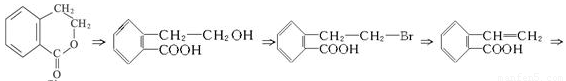
��18�֣���֪���� CH3CH=CHCH2CH3 CH3COOH��CH3CH2COOH
CH3COOH��CH3CH2COOH
�� R��CH=CH2 R��CH2��CH2��Br
R��CH2��CH2��Br
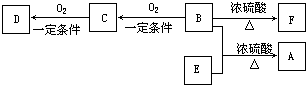
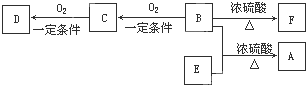
�㶹�صĺ��Ľṹ�Ƿ�������A��A�����в���ת��Ϊˮ���ᡣ

��ش��������⣺
��1�������й�A��B��C�������в���ȷ����
a��C�к˴Ź���������8�ַ� b��A��B��C���ɷ����Ӿ۷�Ӧ
c��1mol A����ܺ�5mol���������ӳɷ�Ӧ d��B����Ũ��ˮ����ȡ����Ӧ
��2��B��������2�����������ţ��ֱ�Ϊ �� ������������ƣ���B��C�ķ�Ӧ����Ϊ ��
��3��������ת�������У���Ӧ����B��C��Ŀ���� ��
��4��������D�ж���ͬ���칹�壬����һ��ͬ���칹���DZ��ĶԶ�ȡ�����ˮ������ɵIJ���֮һ�ܷ���������Ӧ����д������һ�ֵĽṹ��ʽ�� ��
��5��д���ϳɸ߷��ӻ�����E�Ļ�ѧ��Ӧ����ʽ�� ��
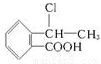
��6��д���� Ϊԭ���Ʊ�
Ϊԭ���Ʊ� �ĺϳ�·������ͼ�����Լ����ã�����ע����Ӧ�������ϳ�·������ͼʾ�����£�
�ĺϳ�·������ͼ�����Լ����ã�����ע����Ӧ�������ϳ�·������ͼʾ�����£� 
��15�֣�
��1��c��2�֣� ��2���Ȼ������ǻ� ȡ����Ӧ��3�֣�
��3���������ǻ���ʹ֮����������2�֣�
��4�� ��2�֣�
��2�֣�
��5����2�֣�
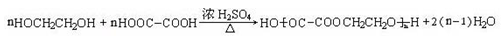
��6����4�֣�
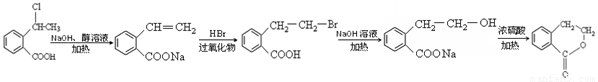
����������1������ʾ�ٿ�֪����Ӧ�����к���COOH�ĵط�ӦΪ��Ӧ���к��С�CH=CH���ṹ�ĵط������Ҷ����D�Ľṹ��ʽ����֪C�Ľṹ��ʽΪ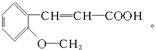
����AΪ��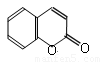 ��BΪ
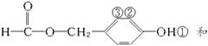
��BΪ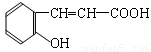 ��B�ķӡ�OH��CH3I����ȡ����Ӧ�õ�C��
��B�ķӡ�OH��CH3I����ȡ����Ӧ�õ�C��
��1����ϸ����ʵĹ����ſ�֪ABC�����ʾ��ɷ����Ӿ۷�Ӧ��C��Hԭ�ӵ�λ���а��֡�B���зӡ�OH�������岻����ȡ����Ӧ����1mol A����ܺ�4mol���������ӳɷ�Ӧ(�����е�˫�����ܼӳ�)
��2��B���������Ȼ������ǻ���B����CΪȡ����Ӧ
��3���ۺϿ���ת�����̿ɿ�����Ϊ��ֹ�ӡ�OH�������Ƚ��䱣������
��4������D��ͬ���칹���ˮ�����ɷ���������Ӧ������ͬ���칹���Ϊ�������Ľṹ�����Ķ�ȡ�����У�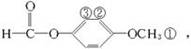
 ��
��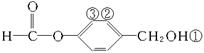 ��9��
��9��
��5�����۷�Ӧ
��6������ɲ������Ƶķ�ʽ���������
 ��Ȼ��˳��д����Ӧ���̼���
��Ȼ��˳��д����Ӧ���̼���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?�Ϸ�һģ���л���A��C10H20O2������������ζ����֪��
��2012?�Ϸ�һģ���л���A��C10H20O2������������ζ����֪��| Ũ���� |
| �� |
| Ũ���� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���㽭ʡ�߿���ѧģ���Ծ��������������棩 ���ͣ������
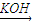 CH3CH ��OH��CH2CHO
CH3CH ��OH��CH2CHO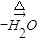 CH3CH=CHCHO���ö�ȩ
CH3CH=CHCHO���ö�ȩ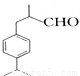 ��ʳƷ����ױƷ�ȹ�ҵ�������Ӽ�����ϳ����̣����ֲ��P��Ӧ����������ȥ��
��ʳƷ����ױƷ�ȹ�ҵ�������Ӽ�����ϳ����̣����ֲ��P��Ӧ����������ȥ��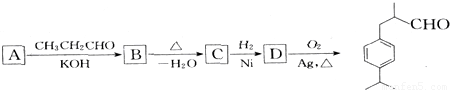
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com