
����Ŀ����1�����ࡢ��֬�������ʺ�ά���ض�������Ļ���Ӫ�����ʣ��±�ΪijƷ������Ƭ��ǩ�е�һ���֡�
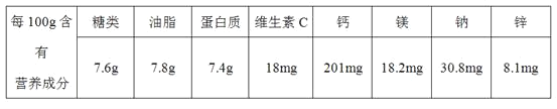
������Ƭ��Ӫ���ɷ��У�����ˮ��Ӧ���ɰ������Ӫ��������_________��ÿ��Ӫ����������ʱ�ų�����������_________��һ��Ӫ������������־���ᵽ�ġ�̼ˮ�������ָ_________������������Ԫ����_________��
��2��ά����C������ˮ������ˮ��Һ�е�����ɫʯ����Һ��ʯ����ɫ�����ȸ���Һ�����ڣ���ɫ��ʧ����ˣ��������ά����C��ʳ��ʱ��Ӧ��ע��_________���ڼ��������£�ά����C�ױ���������������ʱ��ü�һ��_________��
��3�����Ǵ����·�ͨ��������ά֯�ɵģ���������ά��������ë�����ڵȣ������շ��ɳ�������������ά����������ά��źֱ����ղ�������ζ���£�

����ë�ı��Ϊ_________�����ı��Ϊ_________�����ڵı��Ϊ_________��
���𰸡������� ��֬ ���� п ��Ҫ���¼��� ʳ�� �� �� ��
��������
��1���������ܷ���ˮ�����ɰ����ᡣ1����֬�����������ų�������Ϊ39.3ǧ����Զ��������͵����ʡ������ֳ���̼ˮ������ʴ�Ϊ�������ʣ���֬�����ࣻ
��2���ơ�þ���ƶ��dz���Ԫ�أ�п����Ԫ�ء�ά����C��ˮ��Һ�е�����ɫʯ����Һ��죬˵��ά����C��ˮ��Һ�����Եģ����������ڣ���ɫ��ʧ��˵��ά����C�������ױ������������������ά����C��ʳ��ʱ����Ҫ���¼��ȡ����������£�ά����C���ױ����������������������ʱ���һ���ʳ���к͡��ʴ�Ϊ��п����Ҫ���¼��ȣ�ʳ�ף�
��3����ë����ë���ǵ����ʣ����յ�ʱ����ζ����ͬ�ġ�����ֽ�ŵ���Ҫ�ɷֶ�����ά�أ�����ʱ��ζ��ͬ�������Ǻϳ���ά������ʱ����������ζ���ʴ�Ϊ���ۣ��ڣ��١�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.һ�ܷ���ϵ�з������з�Ӧ��N2��3H2![]() 2NH3 ��H<0����ͼ��ijһʱ����з�Ӧ�����뷴Ӧ���̵����߹�ϵͼ��
2NH3 ��H<0����ͼ��ijһʱ����з�Ӧ�����뷴Ӧ���̵����߹�ϵͼ��
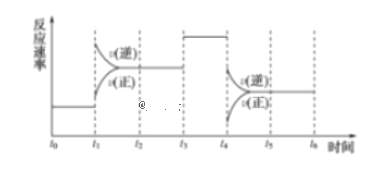
�ش��������⣺
��1������ƽ��״̬��ʱ�����___________��___________��___________��
��2��t1��t3��t4ʱ����ϵ�зֱ���ʲô���������˱仯��____________��___________��___________��
��3�����и�ʱ���ʱ�����İٷֺ�����ߵ���___________������ţ���
A��t0��t1 B��t2��t3 C��t3��t4 D��t5��t6
II.830Kʱ�����ܱ������з������п��淴Ӧ��CO��g��+H2O��g��![]() CO2��g��+H2��g����H��0���Իش��������⣺
CO2��g��+H2��g����H��0���Իش��������⣺
��4������ʼʱc��CO��=2mol��L-1��c��H2O��=3mol��L-1���ﵽƽ��ʱCO��ת����Ϊ60%�����ڸ��¶��£��÷�Ӧ��ƽ�ⳣ��K=____________��
��5������ͬ�¶��£�����ʼʱc��CO��=1mol��L-1��c��H2O��=2mol��L-1����Ӧ����һ��ʱ����H2��Ũ��Ϊ0.5mol��L-1�����ʱ�÷�Ӧ�Ƿ�ﵽƽ��״̬______������������������������ʱv������____v���棩��������������С������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ�ⳣ����Ka��Kb����ˮ�����ӻ�������Kw�����ε�ˮ�ⳣ����Kh���ǵ������Һ�е���������ѧϰ������Ҫע�����ǵ���������ϵ��ͨ��ѧϰ�����֪ʶ�����������ϰ��
(1)��֪��a.�����£������NH3H2O�ĵ��볣����ͬ��
b.CH3COOH+NaHCO3�TCH3COONa+CO2��+H2O
��CH3COONH4��Һ��_______��(��"��"��"��"��"��"����ͬ)��
��NH4HCO3��Һ��________�ԣ���Һ�����ʵ���Ũ������������______���ѧʽ����
(2)����ʱ����������ζ���ˮ�����ζ�������pH=9ʱ������Һ������4c(NH4+)=7c(NH3��H2O)����ˮ�ĵ���ƽ�ⳣ��Kb(NH3��H2O)=____________������ֵ����
(3)100��ʱ��Kw=1.0��10-12�����¶��²��0.1mol/L Na2A��Һ��pH=6��
��H2A��ˮ��Һ�еĵ��뷽��ʽΪ__________________________________
�ڸ��¶��£���0.01mol/L H2A ��Һϡ��20������Һ��pH=__________
(4)��֪������CN����ˮ�ⳣ��Kh��1.61��10��5�������£��������ʵ���Ũ�ȵ�HCN��NaCN�Ļ����Һ��______(������������������������)�ԣ�c(CN��)_____(������������������������)c(HCN)��
ѧ���⣺�����ϵĽ��˼��������ƽ�ⳣ����Ka����ˮ�����ӻ�������Kw�����ε�ˮ�ⳣ����Kh��֮����ʲô��ϵ����д�����ǵĹ�ϵʽ____________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ����ᶡ���Ļ����¶ȣ���Ӧ�¶ȣ���115��125�棬�����й��������±��������¹���ʵ�����Ʊ����ᶡ��������������ǣ�������
���� | ���� | 1-���� | ���ᶡ�� | 98%Ũ���� |
�е� | 117.9�� | 117.2�� | 126.3�� | 338.0�� |
�ܽ��� | ��Һˮ���л��� | ��Һˮ���л��� | ����ˮ����Һ�л��� | ��ˮ��� |
A.��Լ�����������1�����������ʵ���֮��Ӧ����1��1
B.����ˮԡ��������Ϊ���ᶡ���ķе����100��
C.�ӷ�Ӧ������������Ʒ�ķ�������Na2CO3��Һϴ�Ӻ��Һ
D.�ɴ�Ʒ�ƾ�Ʒ��Ҫ���е�һ������������ˮ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����̼���⡢��3��Ԫ����ɵ��л���A����Է�������Ϊ152���������C��Hԭ�Ӹ�����Ϊ1��1����Ԫ�ص���������Ϊ31.58%��A��FeCl3��Һ����ɫ��A����NaHCO3��Һ��Ӧ���䱽���ϵ�һ��ȡ���������֣���ش��������⣺
��1��A�ķ���ʽ��_______________________________��
��2��A�Ľṹ��ʽΪ________________________________________��
��3��A���Է�����ͼ��ʾת����ϵ��D�ķ���ʽΪC10H12O3��A��C��Ӧ�Ļ�ѧ����ʽ________��

��4���ס�����װ�þ�������ʵ������C��ȡB��װ�ã���ͼ���ø���ԡ����(���ͷе�290 �棬�۵�18.17 ��)���������¶ȴﵽ��Ӧ�¶�ʱ����ʢ��C��Ũ������Һ����ƿ��������У��ܿ�ﵽ��Ӧ�¶ȡ��ס�����װ����Ƚϣ���װ������Щ�ŵ�________________________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ܱ������У��ֱ����������ͬ�ļס����������壬�����������¶Ⱥ�ѹǿ����ͬ���Ҽ��ܶȴ����ҵ��ܶȣ�������˵����ȷ����(����)
A.���ʵ������ף���B.����������ף���
C.Ħ��������ף���D.��Է����������ף���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��W��Ϊ������Ԫ�أ�������Ԫ�����ڱ������λ����ͼ��ʾ����Zԭ�ӵ������������ǵ�һ���������3��������˵����ȷ���ǣ�������

A.Z������������Ӧ��Y����
B.X��W��ԭ�Ӻ�����������9
C.X����������ǿ��Y����
D.����������Ӧˮ��������W��Zǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϱ���ϩ�Ǻϳ���֬�����ӽ�����֬���ϳ��ȵ���Ҫ���壬��ͼ�DZ���ϩ�Ľṹ��ʽ��![]() ,���й��ڸ��л����˵������ȷ����(����)
,���й��ڸ��л����˵������ȷ����(����)
A. ����ϩ�ķ���ʽΪC8H8
B. ����ϩͨ���Ӿ۷�Ӧ���Ʊ��߷��ӻ�����
C. ����ϩ��������Ȼ�̼��Һ��Ӧ��![]()
D. ����ϩ�ܷ����ӳɷ�Ӧ�������ܷ���ȡ����Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A~F�����л���������ǵ�ת����ϵ���£�
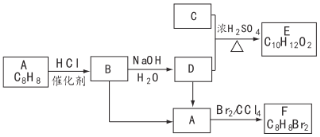
��ش��������⣺
(1)������C�к��й����ŵ�����Ϊ________��AΪһȡ���������������̼ԭ�������________����
(2)D�к���һ��������B����D�Ļ�ѧ����ʽΪ________��
(3)��A����B�ķ�Ӧ����Ϊ________��
(4)��B����A�ķ�Ӧ������________��
(5)E���������������У���ṹ��ʽΪ________��
(5)��F��ͬ���칹���У�������һ��������ֻ��һ�֣��˴Ź�����������ҷ������Ϊ![]() ����________����ṹ��ʽ����
����________����ṹ��ʽ����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com