
反应4NH3(g)+5O2(g)===4NO(g)+6H2O(g)在2 L密闭容器中进行1 分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
A.NO:0.001mol·L-1
B.H2O:0.002mol·L-1
C.NH3:0.002mol·L-1
D.O2:0.0025mol·L-1
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某化学小组用如图所示装置制取氯气,下列说法不正确的是( )

A.该装置图中至少存在两处明显错误
B.该实验中收集氯气的方法不正确
C.为了防止氯气污染空气,必须进行尾气处理
D.在集气瓶的导管口处放一片湿润的淀粉碘化钾试纸可以证明是否有氯气逸出
查看答案和解析>>
科目:高中化学 来源: 题型:
金属铝质轻且有良好的防腐蚀性,在国防工业中有非常重要的作用。请完成下列空白:
(1)铝元素在周期表中的位置为________。
(2)在19世纪时,铝是一种珍贵的金属。人们最初得到的铝粒如同珍宝,它的价格同黄金 相当。1827年,德国化学家维勒用金属钾与无水氯化铝反应而制得了金属铝。用钾与无水氯化铝反应制铝而不用氯化铝溶液的理由是_________。
现代工业炼铝的原料是由铝土矿提取而得,在提取过程中通入的气体为____。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛按一定比例混合在高 温下煅烧,所得物质可作耐高温材料,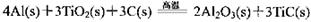
 则反应过程中,每转移1 mol电子放出的热量为________。
则反应过程中,每转移1 mol电子放出的热量为________。
(4)硅与铝同周期,地壳里硅铝的含量:硅________铝(填>,<或=)。是硅酸盐玻璃 (Na2CaSi6O14)的主要成分,Na2CaSi6O14也可写成 。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
。盛放NaOH溶液的试剂瓶若用玻璃瓶塞容易形成粘性的硅酸盐而无法打开,发生反应的化学方程式 ________。长石是铝硅盐酸,不同类长石其氧原子的物质的量分数相同。由钠长石化学式NaAlSi3O8可推知钙长石的化学式为________。
(5)用铝和金属氧化物反应制备金属单质是工业上较常用的方法。如:
 利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
利用化学平衡移动原理解释上述方法可制取金属Ba的原因是
_____________________________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
.某工厂用硫酸处理氨气尾气,得到铵盐(不同批次得到a、b、c三种不同的铵盐)。称取不同质量的铵盐,加入到固定量的NaOH溶液中并加热,收集氨气,得到如下生成氨气的量与加入铵盐的量关系图:
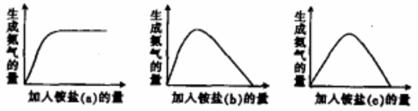
下列判断不正确的是:
A. a对应的铵盐是(NH4)2SO4
B. b对应的铵盐是(NH4)2SO4和NH4HSO4
C. c对应的铵盐是NH4HSO4
D. 当b和c铵盐的质量相同时,可得到相同量的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应2A(g)+3B(g)4C(g)+D(g),已知起始浓度c(A)=4mol·L-1,c(B)=3mol·L-1,C、D浓度均等于0,反应开始2秒后达到平衡状态,此时D的平衡浓度为0.5mol·L-1,则下列说法不正确的是( )
A.反应速率v(C)=1mol·L-1·s-1
B.C的平衡浓度为4mol·L-1
C.A的转化率为25%
D.B的平衡浓度为1.5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在一个1 L的密闭容器中,加入2mol A和1mol B,发生下列反应:2A(g)+B(g)3C(g)+D(s),达到平衡时,C的浓度为1.2mol·L-1。
(1)维持容器的温度不变,若缩小容器的体积,则平衡________
移动(填“向正反应方向”或“向逆反应方向”或“不”)。
(2)维持容器的体积和温度不变,按下列四种配比作为起始物质,达到平衡后,C的浓度仍是1.2mol·L-1的是__________。
A.4mol A+2mol B
B.3mol C+1mol D
C.2mol A+1mol B+1mol D
(3)若维持容器内的体积和温度不变,反应从逆反应开始,按不同配比作为起始物质,达到平衡时,C的浓度仍是1.2mol·L-1,则C的起始物质的量应满足的条件是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验测得BeCl2为共价化合物,两个Be—Cl键间的夹角为180°,由此可判断BeCl2属于( )
A.由极性键形成的极性分子
B.由极性键形成的非极性分子
C.由非极性键形成的极性分子
D.由非极性键形成的非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是()
A. 将过量的二氧化碳通入氢氧化钠溶液:CO2+2OH﹣═CO32﹣+H2O
B. 氯化铝溶液中加入过量浓氨水:Al3++4OH﹣═AlO2﹣+2H2O
C. 氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+
D. 碳酸钙和盐酸反应:CO32﹣+2H+═CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com