
 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.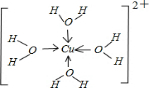 .
. 分析 (1)同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,据此进行判断;
(2)将CN-中C原子及1个负电荷换成1个N原子,可得等电子体N2,将N原子及1个负电荷换成1个O原子,可得等电子体CO;
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键;
(4)①根据磷酸第一步电离出氢离子后变为阴离子,阴离子难电离出带正电荷的氢离子分析;
②根据硝酸、亚硝酸分子中非羟基氧的数目判断;
(5)X+中所有电子正好充满K、L、M三个电子层,X原子核外电子数=2+8+18+1=29,则X为Cu元素,该晶胞中白色小球=8×$\frac{1}{8}$=1,黑色小球=12×$\frac{1}{4}$=3,N3-带3个单位负电荷、Cu+带1个单位正电荷,所以形成的化合物为Cu3N,则白色小球表示N3-、黑色小球表示Cu+,根据晶胞结构图可判断与同一个N3-相连的X+的数目;
(6)Cu2+有空轨道,Cu2+能接受孤对电子,H20能提供孤对电子,所以能形成配位键;[X(H2O)4]2+为[Cu(H2O)4]2+离子,据此画出其结构式.
解答 解:(1)C、N、O元素是同一周期相邻元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能C<O<N,
故答案为:C<O<N;
(2)将CN-中C原子及1个负电荷换成1个N原子,可得等电子体N2,将N原子及1个负电荷换成1个O原子,可得等电子体CO,
故答案为:N2;CO;
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N,
故答案为:O-H…N;N-H…O(或O-H…O、N-H…N);
(4)①磷酸第一步电离出氢离子后变为阴离子,阴离子难电离出带正电荷的氢离子,所以H3PO4的K1远大于K2,
故答案为:第一步电离生成的负离子较难再进一步电离出带正电荷的H+;
②由于硝酸中非羟基氧是两个,亚硝酸非羟基O是一个,非羟基氧越多酸性越强,所以硝酸比亚硝酸酸性强,
故答案为:硝酸中非羟基氧是两个,亚硝酸非羟基O是一个,非羟基氧越多酸性越强;
(5)X+中所有电子正好充满K、L、M三个电子层,X原子核外电子数=2+8+18+1=29,则X为Cu元素,Cu元素是29号元素,原子核外电子数为29,核外电子排布式为ls22s22p63s23p63d104s1;
该晶胞中白色小球=8×$\frac{1}{8}$=1,黑色小球=12×$\frac{1}{4}$=3,N3-带3个单位负电荷、Cu+带1个单位正电荷,所以形成的化合物为Cu3N,则白色小球表示N3-、黑色小球表示Cu+,同一个N3-相连的Cu+有6个,
故答案为:ls22s22p63s23p63d104s1;X+与N3-形成的晶体化学式是Cu3N,因此白球是N3-,所以与同一个N3-相连的X+有6个;
(6)Cu2+与H2O与之间的化学键类型为配位键,Cu2+有空轨道,Cu2+能接受孤对电子,H20能提供孤对电子,所以能形成配位键;
[X(H2O)4]2+离子为[Cu(H2O)4]2+,[Cu(H2O)4]2+离子中含有配位键,其结构式为: ,
,
故答案为:配位键;H20能提供孤对电子,Cu2+能接受孤对电子(或Cu2+有空轨道); .
.
点评 本题考查了配合物的成键情况、电离能、氢键、电子排布式等知识,题目难度中等,注意掌握电离能大小比较方法及配合物的成键情况,明确氢键、电子排布式的表示方法,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.


 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | v(Fe)=0.5 mol/(L•min) | B. | v(H2SO4)=1 mol/(L•min) | ||
| C. | v(H2SO4)=0.5 mol/(L•min) | D. | v(FeSO4)=1 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下将铜丝插入浓硫酸中,会产生有刺激性气味的气体,且溶液的变为蓝色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 将CuCl2溶液在蒸发皿中加热蒸干,无法得到无水CuCl2固体 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入硝酸中浸泡,既除去铜绿,又不能损伤铜器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | NaCl═Na++Cl-; NH3•H2O?NH4++OH- | 均属于电离方程式 |
| B | Ba2++SO42-═BaSO4↓; HCO3-+OH-═CO32-+H2O | 均可表示一类反应 |
| C | 向溶液中滴加盐酸酸化过的BaCl2溶液,出现白色沉淀 | 说明该溶液中一定有SO42- |
| D | Cl2+2NaOH═NaCl+NaClO+H2O; 3S+6NaOH═2Na2S+Na2SO3+3H2O | Cl2和S在反应中既作氧化剂又作还原剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol/L的NaCl溶液 | B. | 75mL 1mol/L的FeCl3溶液 | ||
| C. | 150mL 0.5mol/L的MgCl2溶液 | D. | 75mL 2mol/L的NH4Cl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA | |
| B. | 1L1mol•L-1 的CaCl2溶液中含Cl-的数目为NA | |
| C. | 在标准状况下,22.4L H2O的质量约为18g | |
| D. | 22gCO2与标准状况下11.2LH2O含有相同的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 molH-H键断裂的同时生成2 molH-I键 | |
| B. | v(H2)═v(I2) | |
| C. | 混合气体的颜色不再改变 | |
| D. | 混合气体的平均分子量不再发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com