已知A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,C元素原子的最外层电子数是次外层的3倍,D原子的最内层电子数和最外层电子数之和等于其次外层电子数,E单质性质活泼;B和C可形成多种气态化合物.A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝.请回答下列问题:
(1)写出C元素在周期表中的位置______.
(2)写出B单质分子的电子式______;乙分子的结构式______.
(3)化肥甲的俗称是______;甲晶体中含有的化学键类型有______.
(4)元素D与元素E相比,非金属性较强的是______(用元素符号表示),请例举能证明这一结论的两个事实______、______.
(5)往甲的浓溶液中加入NaOH的浓溶液并加热,反应的离子方程式是______ NH3↑+H2O
【答案】
分析:A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,则A为氢元素;C元素原子的最外层电子数是次外层的3倍,则C原子有2个电子层,最外层电子数为6,则C为氧元素;D原子的最内层电子数和最外层电子数之和等于其次外层电子数,则D原子最外层电子数为8-2=6,则D为硫元素;E单质性质活泼,原子序数大于硫元素,则E为Cl元素;B和C可形成多种气态化合物,A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,则B为氮元素,甲为硝酸铵;甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝,则乙为氨气,以此解答.
解答:解:A、B、C、D、E均为短周期元素,它们的原子序数依次递增.A单质是自然界中密度最小的气体,则A为氢元素;C元素原子的最外层电子数是次外层的3倍,则C原子有2个电子层,最外层电子数为6,则C为氧元素;D原子的最内层电子数和最外层电子数之和等于其次外层电子数,则D原子最外层电子数为8-2=6,则D为硫元素;E单质性质活泼,原子序数大于硫元素,则E为Cl元素;B和C可形成多种气态化合物,A、B、C三种元素可以形成离子化合物甲,甲是一种常见的化肥,则B为氮元素,甲为硝酸铵;甲可以和氢氧化钠反应放出无色刺激性气味气体乙,乙能使湿润的红色石蕊试纸变蓝,则乙为氨气,
(1)C为氧元素,氧原子有2个电子层,最外层电子数为6,处于周期表中第二周期ⅥA族,故答案为:第二周期ⅥA族;
(2)B为氮元素,氮气分子中氮原子之间形成3对共用电子对,氮气分子的电子式为
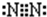
,乙为氨气分子,分子中氮原子与氢原子之间形成1对共用电子对,氨气分子的结构式为
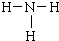
,故答案为:
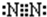
;
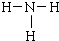
;
(3)甲是硝酸铵,俗称是硝铵;甲晶体中含有的化学键类型有:离子键、共价键,
故答案为:硝铵;离子键、共价键;
(4)同周期自左而右非金属性增强,故非金属性Cl>S,氯化氢比硫化氢稳定、高氯酸酸性比硫酸强等证明这一结论,
故答案为:Cl;氯化氢比硫化氢稳定;高氯酸酸性比硫酸强;
(5)往硝酸铵的浓溶液中加入NaOH的浓溶液并加热,反应产生硝酸钠、氨气与水,反应的离子方程式是:NH
4++OH
-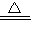
NH
3↑+H
2O,
故答案为:NH
4++OH
-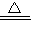
NH
3↑+H
2O.
点评:本题考查结构性质位置关系、物质推断、常用化学用语等,难度不大,推断元素是解题的关键,注意对基础知识的理解掌握.

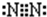 ,乙为氨气分子,分子中氮原子与氢原子之间形成1对共用电子对,氨气分子的结构式为
,乙为氨气分子,分子中氮原子与氢原子之间形成1对共用电子对,氨气分子的结构式为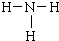 ,故答案为:
,故答案为: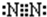 ;
;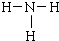 ;
; NH3↑+H2O,
NH3↑+H2O, NH3↑+H2O.
NH3↑+H2O.

 备战中考寒假系列答案
备战中考寒假系列答案

 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: