
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 食盐可做调味剂,也可做食品防腐剂 | |
| B. | 单质硅是制造太阳能电池和光导纤维的常用材料 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 聚乙烯塑料制品可用于食品的包装 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应时间/h | 1 | 4 | 9 | 16 | 25 |
| MgO层厚/nm | 0.05a | 0.2a | 0.45a | 0.8a | 1.25a |
| NiO层厚/nm | b | 2b | 3b | 4b | 5b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2O的质量为18g/mol | |
| B. | 11.2L氯气所含的分子数为0.5NA | |
| C. | 0.1mol/L的Na2CO3溶液中所含Na+的物质的量为0.2mol | |
| D. | 常温常压下,1mol氦气含有的核外电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCO3、MgO、Mg2N3 | B. | MgCO3、MgO、Mg(OH)2 | C. | MgO、Mg2N3、C | D. | MgCO3、C、Mg2N3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
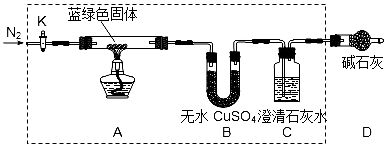
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g | B. | 50g | C. | 72g | D. | 80g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
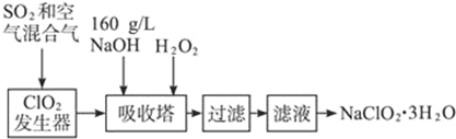
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com