
【题目】根据题意解答
(1)现有m g某气体,它是三原子分子,其摩尔质量为M gmol﹣1 . 若阿伏伽德罗常数用NA表示,该气体所含原子总数为个,该气体在标准状况下的体积为L.
(2)在标准状况下,由CO和CO2组成的混合气体为67.2L,质量为120g,此混合物中CO和CO2物质的量之比是 , CO的质量是 , 混合气体的平均摩尔质量是 .
(3)若40g密度为ρ gcm﹣3的硝酸钙溶液里含2g Ca2+ , 则NO3﹣的物质的量浓度是 .
(4)将标准状况下的VL氨气溶于100g水中,得到的氨水密度为ag/cm3 , 则该溶液的物质的量浓度为 .
(5)标准状况下,现有①6.72L CH4 ②3.01×1023个HCl分子 ③13.6g H2S ④0.2mol NH3 , 对这四种气体的关系有以下四种表述:其中正确的是
a.体积:②>③>①>④b.物质的量:②>③>④>①
c.质量:②>③>①>④d.氢原子个数:①>③>④>②
(6)按体积比为1:2:3所组成的N2、O2、CO2 , 混合气体20g在标准状况下体积为L.
【答案】
(1)![]() NA;
NA;![]()
(2)1:3;21g;40g/mol
(3)2.5ρ mol/L
(4)![]() mol/L
mol/L
(5)acd
(6)12
【解析】解:(1)该气体的物质的量为:n= ![]() =
= ![]() mol,该气体分子中含有3个原子,则含有原子的物质的量为
mol,该气体分子中含有3个原子,则含有原子的物质的量为 ![]() mol×3=
mol×3= ![]() mol,含有原子数为:N=nNA=
mol,含有原子数为:N=nNA= ![]() ×NA=
×NA= ![]() NA;标准状况下该气体的体积为:22.4L/mol×
NA;标准状况下该气体的体积为:22.4L/mol× ![]() mol=
mol= ![]() L,所以答案是:
L,所以答案是: ![]() NA;
NA; ![]() ;(2)标准状况下,混合气体的物质的量为:
;(2)标准状况下,混合气体的物质的量为: ![]() =3mol,
=3mol,
设CO的物质的量为x,CO2的物质的量为y,则:![]() ,
,
解得:x=0.75mol,y=2.25mol,
此混合物中CO和CO2物质的量之比=0.75mol:2.25mol=1:3;
CO的质量为:m(CO)=0.75mol×28g/mol=21g;
混合气体的平均摩尔质量M= ![]() =40g/mol,
=40g/mol,
所以答案是:1:3;21g;40g/mol;(3)2g Ca2+的物质的量为: ![]() =0.05mol,溶液中n(NO3﹣)=2n( Ca2+)=0.05mol×2=0.1mol,溶液体积为:
=0.05mol,溶液中n(NO3﹣)=2n( Ca2+)=0.05mol×2=0.1mol,溶液体积为: ![]() =
= ![]() L,NO3﹣的物质的量浓度为:
L,NO3﹣的物质的量浓度为: ![]() =2.5ρ mol/L,
=2.5ρ mol/L,
所以答案是:2.5ρ mol/L;(4)标准状况下VL氨气的物质的量为: ![]() =
= ![]() mol,氨气的质量为:17g/mol×
mol,氨气的质量为:17g/mol× ![]() mol=
mol= ![]() g,所得溶液的质量为:
g,所得溶液的质量为: ![]() g+100g,所得溶液的体积为:
g+100g,所得溶液的体积为: ![]() =
= ![]() L,该溶液的物质的量浓度为:
L,该溶液的物质的量浓度为: 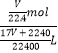 =
= ![]() mol/L,
mol/L,
所以答案是: ![]() mol/L;(5)①6.72L CH4的物质的量为:
mol/L;(5)①6.72L CH4的物质的量为: ![]() =0.3mol,②3.01×1023 个HCl分子的物质的量为:
=0.3mol,②3.01×1023 个HCl分子的物质的量为: ![]() =0.5mol,③13.6g H2S的物质的量为
=0.5mol,③13.6g H2S的物质的量为 ![]() =0.4mol,④0.2mol NH3 ,
=0.4mol,④0.2mol NH3 ,
a.根据V=nVm知,相同条件下体积之比等于物质的量之比,故体积④<①<③<②,故正确;
b.由上述计算可知,物质的量为④<①<③<②,故错误;
c.甲烷质量为0.3mol×16g/mol=4.8g,HCl的质量为0.5mol×36.5g/mol=33.25g,氨气的质量为0.2mol×17g/mol=3.4g,故质量④<①<③<②,故正确;
d.甲烷中n(H)=0.3mol×4=1.2mol,HCl中n(H)=0.5mol,硫化氢中n(H)=0.4mol×2=0.8mol,氨气中n(H)=0.2mol×3=0.6mol,故H原子数目②<④<③<①,故正确;
所以答案是:acd;(6)体积之比等于物质的量之比,令氮气的物质的量为xmol,则氧气为2xmol,二氧化碳为3xmol,所以:xmol×28g/mol+2xmol×32g/mol+3xmol×44g/mol=20g,
解得:x= ![]() mol,
mol,
所以标准状况下,混合气体的体积为( ![]() mol+2×
mol+2× ![]() mol+3×
mol+3× ![]() mol)×22.4L/mol=12L,
mol)×22.4L/mol=12L,
所以答案是:12.


科目:高中化学 来源: 题型:
【题目】向10mL某浓度的NaOH溶液中通入CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加入0.1mol/L盐酸,产生的气体V(CO2)与加入盐酸的体积V(HCl)的关系有图示两种情况,则下列分析判断不正确的是(不考虑CO2的溶解)( )

A. 曲线A表明M中的溶质为NaOH、Na2CO3
B. 曲线B表明M中NaHCO3与Na2CO3的物质的量之比为1:2
C. 原NaOH溶液的物质的量浓度为0.75mol/L
D. 由A.B可知,两次实验通入的CO2的体积比3:10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期律的知识,下列两者性质比较中,不正确的是
A. 热稳定性:PH3<NH3 B. 金属性强弱:Na>Mg>Al
C. 酸性强弱:HF>HCl>HBr>HI D. 原子半径:K>Si>Cl>F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中一种,若将纳米碳均匀地分散到
蒸馏水中,所形成的分散系:①是溶液②是胶体③能产生丁达尔效应④分散质粒子能透过滤纸⑤分散质粒子不能透过滤纸⑥静置后,会析出黑色沉淀.
A. ①④⑥ B. ②③④ C. ②③⑤ D. ①⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组为验证常见还原剂SO2、I-、Fe2+的还原性强弱的顺序为:SO2>I->Fe2+,用下图所示装置进行实验(加热和夹持装置已略,气密性已检验)。

(1)上述实验需要加热的装置是__________
(2)A中反应的化学方程式为________,
(3)D中,烧杯盛放的是_______
(4)实验开始时,关闭K1,打开K2,通入少量氯气,写出B中发生反应的离子方程式____________
①为验证I-的还原性比Fe2+强,取(4)后B中的少量溶液于试管中,应再往试管中滴入______溶液,现象是______
②在(4)后,为了比较SO2和I-的还原性强弱,接下来的操作是____
A.打开K1 B.打开K2 C.同时打开K1和K2
(5)若打开K2,通入Cl2恰好将Fe2+、I-全部氧化后,再打开K1通入SO2,当Fe3+全部转化为Fe2+时,此时通入的SO2的体积(标准状况下)为_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将1molCO和1molH2O(g)通入一个密闭容器中反应:CO(g)+H2O(g)CO2(g)+H2(g),达到平衡后CO2的物质的量为0.6mol,再通入4molH2O(g)达到平衡后CO2的物质的量可能是( )
A. 等于0.6mol B. 等于1mol C. 大于1mol D. 大于0.6mol,小于1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类组合正确的是
A | B | C | D | |
纯净物 | 空气 | NaOH | 稀盐酸 | FeSO4·7H2O |
非电解质 | H2O | Na2O | CO | NH3 |
电解质 | HNO3 | Cu | 蔗糖 | CH3COOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.具有相同通式的有机物不一定互为同系物
B.分子组成相差一个或若干个CH2原子团的化合物不一定互为同系物
C.所有的烷烃之间一定互为同系物
D.两个相邻同系物的相对分子质量数值一定相差14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com