
����Ŀ��I.ijͬѧ�����ͼ��ʾװ��̽�������ܷ���ˮ������Ӧ������a����Ҫ�ɷ��Ǻ�������ˮ��������������ش��������⣺


��1������a��ͼ�����Ʊ� ����ѡ��ͼ2�еļ�װ�ã���Ӧ�����ӷ���ʽ��_____����ѡ��װ���ң����еĵ��� a ��������_____��
��2��֤��������ˮ������Ӧ��ʵ������Ϊ_________________________��
��3����ʵ����ƴ���ȱ�ݣ�Ϊ�˿˷���ȱ�ݣ���Ҫ����װ��D�����з�����Ӧ�����ӷ���ʽΪ_________________��
II.��ͼΪŨ������ͭ��Ӧ�����������ʵ��װ��

�ش��������⣺
��1��ָ���Թ�c�в�����ʵ������______________________��
��2���ÿɳ鶯��ͭ˿����ͭƬ���ŵ�___________��
��3��д��Ũ������ͭ��Ӧ�Ļ�ѧ����ʽ��_____________________________��
��4��Ϊȷ��CuSO4���ɽ� _____________________________ �ɹ۲���ɫ
III.ijѧϰС�鿪չ����ʵ��̽�����
ѡ�������װ�ú�ҩƷ̽��������������������ǿ����


װ������˳��ΪA��C��_____��_____��D��F��ͨ��_____________����֤�������������ǿ�ڴ����ᡣ
���𰸡�MnO2+ 4H++2Cl-![]() Cl2��+Mn2++2H2O ƽ����ѹ��ʹ��Һ©���е�Һ����˳������ װ��B�е���ɫ��������ɫ��װ��C�е���ɫ������ɫ Cl2+2OH-=Cl-+ClO-+H2O ʯ����Һ���ɫ ���Ʒ�Ӧ��ʱ��ʼ��ʱֹͣ Cu+2H2SO4��Ũ��
Cl2��+Mn2++2H2O ƽ����ѹ��ʹ��Һ©���е�Һ����˳������ װ��B�е���ɫ��������ɫ��װ��C�е���ɫ������ɫ Cl2+2OH-=Cl-+ClO-+H2O ʯ����Һ���ɫ ���Ʒ�Ӧ��ʱ��ʼ��ʱֹͣ Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O ���Թ�a�е�Һ����������ʢ������ˮ���Թ��� B E ��D��Ʒ�첻��ɫ��F�г��ְ�ɫ����
CuSO4+SO2��+2H2O ���Թ�a�е�Һ����������ʢ������ˮ���Թ��� B E ��D��Ʒ�첻��ɫ��F�г��ְ�ɫ����
��������
I.��1����ʵ��װ��ͼ��֪����A�м�װ��Ϊ����������Ũ��������Ʊ����������е��ܿ�ƽ����ѹ������Һ������¡�
��2��֤��������ˮ������Ӧ��ʵ������Ϊ��װ��B�е���ɫ��������ɫ��װ��C�е���ɫ������ɫ��
��3����ʵ����ƴ���ȱ�ݣ�Ϊ�˿˷���ȱ�ݣ���Ҫ����װ��D��D���������Ƶȼ�Һ������������ֹ��Ⱦ������
II.����Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O��Ӧ���ص������������ʷ�����
CuSO4+SO2��+2H2O��Ӧ���ص������������ʷ�����
III.���������ǿ�����ԡ�����������л�ԭ�ԣ��������ö���������������ֱ�ӷ�Ӧ�ж�������������������ǿ��������֤���������Ա�̼��ǿ���ٽ��̼�����Ա�HClOǿ�����жϣ�Aװ���Ʊ������������������ӷ����Ʊ��Ķ��������л���HCl���ñ��͵����������Ƴ�ȥHCl����ͨ��̼��������Һ��������֤���������Ա�̼��ǿ�������Ը��������Һ��ȥ������̼�еĶ���������Ʒ����Һ���������̼�ж��������Ƿ��������ͨ��F�У�
I.��1��װ��A���ڲ�����������ѡ��ͼ2�еļ�װ�ã���Ӧ�����ӷ���ʽ��MnO2+ 4H++2Cl-![]() Cl2��+Mn2++2H2O����ѡ��װ���ң����еĵ���a��������ƽ����ѹ��ʹ��Һ©���е�Һ����˳�����¡�
Cl2��+Mn2++2H2O����ѡ��װ���ң����еĵ���a��������ƽ����ѹ��ʹ��Һ©���е�Һ����˳�����¡�
��2��֤��������ˮ������Ӧ��ʵ������Ϊ��װ��B�е���ɫ��������ɫ��װ��C�е���ɫ������ɫ��
��3����ʵ����ƴ���ȱ�ݣ�Ϊ�˿˷���ȱ�ݣ���Ҫ����װ��D��D���������Ƶȼ�Һ������������ֹ��Ⱦ���������ӷ���ʽΪ��Cl2+2OH-=Cl-+ClO-+H2O��
II.��1������������������������Թ�c�в�����ʵ������ʯ����Һ���ɫ��
��2���ÿɳ鶯��ͭ˿����ͭƬ���ŵ���Ʒ�Ӧ��ʱ��ʼ��ʱֹͣ ��
��3��Ũ������ͭ��Ӧ�Ļ�ѧ����ʽΪ�� Cu+2H2SO4��Ũ��![]() CuSO4+SO2��+2H2O��
CuSO4+SO2��+2H2O��
��4��Ϊȷ��CuSO4���ɽ��Թ�a�е�Һ����������ʢ������ˮ���Թ��У�����Һ��������˵��������ͭ���ɡ�
III.���������ǿ�����ԡ�����������л�ԭ�ԣ��������ö���������������ֱ�ӷ�Ӧ�ж�������������������ǿ��������֤���������Ա�̼��ǿ���ٽ��̼�����Ա�HClOǿ�����жϣ�Aװ���Ʊ������������������ӷ����Ʊ��Ķ��������л���HCl���ñ��͵����������Ƴ�ȥHCl����ͨ��̼��������Һ��������֤���������Ա�̼��ǿ�������Ը��������Һ������ȥ������̼�еĶ���������Ʒ����Һ���������̼�ж��������Ƿ��������ͨ��F�У���װ������˳��ΪA��C��B��E��D��F������װ��E�������dz�ȥSO2���壬D��Ʒ�첻��ɫ��F�г��ְ�ɫ��������֤�������������ǿ�ڴ����ᡣ


 ��ѧ����ͬ����ϰϵ�д�
��ѧ����ͬ����ϰϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���ǿ���Ժ�ǿ������Һ�о��ܹ�����������������ǣ� ��
A.NH4+��Cu2+��Cl-��NO3-B.K+��Na+��HCO3-��SO42-
C.Fe2+��NO3-��Na+��ClO-D.Cl-��NO3-��Na+��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������һ��������������ϣ�����һ����ɫ���ɫ�ľ�״���壬�ڿ����г��ڱ�¶�����ջ���̼��ﮡ��������ˮ������������﮺Ͱ������ڿ����м����ܾ���ȼ�գ��ر���ϸ��ĩ״�ĵ���ﮣ���백��Ӧ����LiNH2��H2��ʵ�����ø��������N2�����ﮣ��ܶ�Ϊ0.534g��cm3����Ӧ��ȡ����ﮡ�ij��������ѡ������װ�����ʵ�飨װ�ÿ��ظ�ʹ�ã���

�ش��������⣺
��1����ʵ��������ʯ����Ũ��ˮ����Ʊ����������������������ң�ѡ������װ���Ʊ���������ﮡ�װ������˳��Ϊ__________________________________________��
��2��Eװ�õ�������_____________________________��д��D�л�ѧ����ʽΪ______________________________��
��3��ʵ�鲽�����£���װҩƷ��������Ӧ�������������װ������������ȼC���ƾ�������ȼD���ƾ�������ȷ���Ⱥ�˳��Ϊ________________________________��������ţ�
��4��ʵ���ұ���﮵ķ�����______________��д��C�еĻ�ѧ����ʽ________________________________������﮵ĵ���ʽΪ_______________________________________
��5����Ƽ�ʵ��֤��C�в���Ϊ����ﮣ�___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52g ͭþ�Ͻ���ȫ�ܽ���50mL �ܶ�Ϊ1.40 g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120 mL����״��������Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54 g����������˵������ȷ���ǣ�������
A. �úϽ���ͭ��þ�����ʵ���֮����2:1
B. ��Ũ������HNO3�����ʵ���Ũ����14.0 mol/L
C. NO2��N2O4�Ļ�������У�NO2�����������80%
D. �õ�2.54 g����ʱ������NaOH��Һ�������600 mL
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E����Ԫ�أ�����A��B��C����ͬһ���ڣ�Aԭ�������p����ĵ��������ڴ����ĵ���������BԪ�ؿɷֱ���A��C��D��E����RB2�ͻ������֪��DB2��EB2�У�D��B��������Ϊ7��8��E��B��������Ϊ1��1�����������������ش��������⣺
��1������C��ԭ�ӽṹʾ��ͼ��________��
��2��д��Dԭ�ӵ���Χ�����Ų�ʽ��________��
��3��д��AԪ�ص�����B����ȫȼ�յĻ�ѧ����ʽ��______________��
��4��ָ��EԪ����Ԫ�����ڱ��е�λ�ã�____________��
��5���Ƚ�A��B��C����Ԫ�صĵ�һ�����ܵĴ�С˳��________________(���ɴ�С��˳�����У���Ԫ�ط��ű�ʾ)��
��6���Ƚ�Ԫ��D��E�ĵ縺�Ե���Դ�С��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ɫ��Һ��SO2���ã�������ɫ����Ʒ����Һ ������KMnO4��Һ������ˮ �����з�̪��NaOH��Һ����ʵ����ͬ���� �� ��
A. �٢� B. �٢ڢ� C. �ڢۢ� D. �ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����Ҫ����д���л�ѧ����ʽ�����ױ��Ʊ�TNT
��1��3������ϩ������ʵ����ĵ�������60��ʱ����1��4�ӳ�
��2����������6������������������ص��л����CH3COOH����ζ���� ��HCOOCH3���̲�Ѭ������
��![]() ���Ʒ�ȩ��֬����
���Ʒ�ȩ��֬����![]() ������ɱ�������CH2=CH��CH=CH2���ϳ���ԭ�ϣ���HCHO����������
������ɱ�������CH2=CH��CH=CH2���ϳ���ԭ�ϣ���HCHO����������
��ش�
��a������ȩ���� ������ţ���
��b��������Ϊͬ���칹����� ������ţ���
��c��������Ϊͬϵ����� ������ţ���
��3�����и��������У�����ͬһ�����ʵ��ǣ� ��
A�� |
B�� |
C�� |
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ڵ��Ĺ̶��Ļ�ѧ��Ӧ�� �� ��
A. N2��H2��Ӧ����NH3 B. NO��O2��Ӧ����NO2
C. NH3������������NO D. ��NH3��̼����狀�̼���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں˴Ź��������г�������壬�����շ����֮��Ϊ3��2�Ļ�������(����)
A. 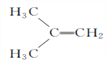 B.
B. ![]()
C. 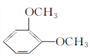 D.
D. ![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com