
����Ŀ��̼�ǵ���������������������Ԫ��֮һ������Ҫ��ش���������:
��1��̼ԭ�ӵļ۵����Ų�ͼ��________________��������______�ֲ�ͬ�˶�״̬�ĵ��ӡ�
��2��̼�����γɶ����л��������ͼ��ʾ��һ�����ʺ�һ����वĽṹ�����ַ���������ԭ�Ӷ���һ��ƽ���ϡ�

������������Ԫ�صĵ縺���ɴ�С��˳��______________________��
�������й��֮��ļнǡ�1�ȡ�2����ԭ��_________________________________��
����ऽṹ��N ԭ�ӵ��ӻ���ʽ___________��
�ܷ����еĴ�м������÷���![]() ��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�����(�籽�����еĴ�м��ɱ�ʾΪ
��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�����(�籽�����еĴ�м��ɱ�ʾΪ![]() )�������ʺ�����ж����д�м������ʸ�����еĴ�м���ʾΪ______________��
)�������ʺ�����ж����д�м������ʸ�����еĴ�м���ʾΪ______________��
��3��̼���γ�CO��CO2��H2CO3�ȶ����������
���ڷ�ӦCO ת����CO2 �Ĺ����У�����˵����ȷ����__________��
A��ÿ�������й¶Ե��������� B�����Ӽ��Ա仯
C��ԭ�Ӽ�ɼ���ʽ�ı� D�����ӵ��۷е���
�ڸɱ��ͱ������ֳ����ķ��Ӿ��壬�����еĿռ������ʣ��ɱ�_______����(�>���� ��<����=��)
��H2CO3��H3PO4����1�����ǻ�����H3PO4Ϊ��ǿ�ᣬH2CO3Ϊ�����ԭ��___________��
��4����2017 �꣬�����ѧ���Ŷӹ�ͬ�ϳ���̼��һ������ͬ�������壺 T- ̼��T- ̼�Ľṹ�ǣ����������ʯ�е�ÿ��̼ԭ����һ����4 ��̼ԭ����ɵ���������ṹ��Ԫȡ�����γ�̼��һ��������ά��������ṹ������ͼ����֪T- ̼��������Ϊa pm������٤������ΪNA����T- ̼���ܶȵı���ʽΪ______________g/cm3��

���𰸡�![]() 6N>C>H����N C H���µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij������������Ǵ�sp3
6N>C>H����N C H���µ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij������������Ǵ�sp3![]() BCD>��������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ���
BCD>��������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ���![]()
��������
��1��̼Ϊ6��Ԫ�أ�̼ԭ�ӵļ۵����Ų�ͼΪ��![]() ��������6�ֲ�ͬ�˶�״̬�ĵ��ӣ���2����Ԫ�صķǽ�����Խǿ���縺����ֵԽ������������Ԫ�صĵ縺���ɴ�С��˳��ΪN > C > H���ڹµ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij���������Խ����Խ����������й��֮��ļнǡ�1�ȡ�2����ऽṹ��N ԭ��������3��ԭ�ӣ�����1���¶Ե��ӣ�����sp3�ӻ����ܷ����еĴ�м������÷���
��������6�ֲ�ͬ�˶�״̬�ĵ��ӣ���2����Ԫ�صķǽ�����Խǿ���縺����ֵԽ������������Ԫ�صĵ縺���ɴ�С��˳��ΪN > C > H���ڹµ��Ӷ�����ϵ��Ӷ�֮��ij������ڼ��ϵ��Ӷ�֮��ij���������Խ����Խ����������й��֮��ļнǡ�1�ȡ�2����ऽṹ��N ԭ��������3��ԭ�ӣ�����1���¶Ե��ӣ�����sp3�ӻ����ܷ����еĴ�м������÷���![]() ��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�������������वĽṹ�����еĴ�м���5��ԭ��6�������γɵı�ʾΪ
��ʾ������m���������γɴ�м���ԭ������n���������γɴ�м��ĵ�������������वĽṹ�����еĴ�м���5��ԭ��6�������γɵı�ʾΪ![]() �� ��3����A��CO������̼�����ϸ���1���¶Ե��ӣ�CO2������̼�����ϸ���2���¶Ե��ӣ�ѡ��A���� B��COΪ���Է��ӣ�CO2Ϊ�Ǽ��Է��ӣ����Ӽ��Ա仯��ѡ��B��ȷ��C��CO�д���̼��������CO2�д���̼��˫����������ԭ�Ӽ�ɼ���ʽ�ı䣬ѡ��C��ȷ��D����Ӧ���е�һ����̼����������Է�������С�������������̼�����ӵ��۷е���ѡ��D��ȷ����ѡBCD����ˮ���Ӽ���������������з����ԣ�����ˮ�����γɱ�ʱ���ڽϴ�Ŀ�϶���ɱ�����֮��ֻ���ڷ��»������γɵķ��Ӿ������ܶѻ��������еĿռ������ʣ��ɱ�>��������������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ��ˣ�������ˮ���������������ܹ���ȫ��Ӧ�������ᣬ�ʴ�Ϊ��������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ��ˣ���4�����ݾ����ṹͼ�������к��е���������ṹ����Ŀ=
�� ��3����A��CO������̼�����ϸ���1���¶Ե��ӣ�CO2������̼�����ϸ���2���¶Ե��ӣ�ѡ��A���� B��COΪ���Է��ӣ�CO2Ϊ�Ǽ��Է��ӣ����Ӽ��Ա仯��ѡ��B��ȷ��C��CO�д���̼��������CO2�д���̼��˫����������ԭ�Ӽ�ɼ���ʽ�ı䣬ѡ��C��ȷ��D����Ӧ���е�һ����̼����������Է�������С�������������̼�����ӵ��۷е���ѡ��D��ȷ����ѡBCD����ˮ���Ӽ���������������з����ԣ�����ˮ�����γɱ�ʱ���ڽϴ�Ŀ�϶���ɱ�����֮��ֻ���ڷ��»������γɵķ��Ӿ������ܶѻ��������еĿռ������ʣ��ɱ�>��������������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ��ˣ�������ˮ���������������ܹ���ȫ��Ӧ�������ᣬ�ʴ�Ϊ��������ˮ�Ķ�����̼����ֻ��Լ���ٷ�֮һ��ˮ��ϳ�̼�ᣬ�밴������̼ȫ��ת��Ϊ̼��������������ǿ����ȣ���Ȼ��С�˽��ٱ��ˣ���4�����ݾ����ṹͼ�������к��е���������ṹ����Ŀ=![]() ��ÿ����������ṹ����4��̼ԭ�ӣ�����������=
��ÿ����������ṹ����4��̼ԭ�ӣ�����������=![]() ����֪T- ̼��������Ϊa pm������٤������ΪNA����T- ̼���ܶ�Ϊ
����֪T- ̼��������Ϊa pm������٤������ΪNA����T- ̼���ܶ�Ϊ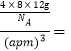
![]() g/cm3��
g/cm3��


 �ƸԴ��ž�ϵ�д�
�ƸԴ��ž�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��������Ź�Բ��õ���ʷ�������й��������漰��ѧ��Ӧ����
A.�õ���ʪ����ͭ
B.������ʯ��¯����
C.����������һ�����������ů��������
D.��ֻҪ���������ĥ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ǰ������ԭ�������������������Ԫ��A��B��C��D��E��F�У�A��B����ͬһ������Ԫ�������ڣ�AԪ�����γɵĻ�����������࣬C��D��E��F��λ��ͬһ���ڵĽ���Ԫ�أ���̬C��Fԭ�ӵļ۵��Ӳ���δ�ɶԵ��Ӿ�Ϊ1������C��Fԭ�ӵĵ��������Ϊ10����̬D��Eԭ�ӵļ۵��Ӳ���δ�ɶԵ������ֱ�Ϊ4��2����ԭ���������Ϊ2��
��1��д��D��Ԫ�����ڱ��е�λ��Ϊ___________________ �������������ӵļ۲�����Ų�ͼΪ___________________ ��
��2��FԪ��λ��Ԫ�����ڱ�_________�������̬ԭ����_________��������ͬ�ĵ��ӣ�
��3���ڶ������л�̬ԭ��δ�ɶԵ�������E��ͬ�ҵ縺�Խϴ��Ԫ��Ϊ___________��дԪ�ط��ţ���
��4��E���ʿ������������ӻ������������H2�ӳɵĴ��������������ӺͶ�����������20![]() ˮ�е��ܽ��֮��Ϊ0.39����ԭ��Ϊ___________________��
ˮ�е��ܽ��֮��Ϊ0.39����ԭ��Ϊ___________________��
��5����Ѫ������A��B��C��D����Ԫ���γɵ���λ������C4[D(AB)6]��������ˮ���㷺����ʳ�����Ӽ��������������Ѫ�ε��ڽ���_____(д����ѧʽ)����Ѫ����Һ��ϡ�������ʱ������������ԭ��Ӧ�����������κ�һ�����Ѫ�ε����廥Ϊ�ȵ��������̬�����д������̬������ĵ���ʽ__________��
��6��E2+��Mg2+��O2���γɾ���ľ����ṹ������ͼ��ʾ��E2+δ����������þ���Ļ�ѧʽΪ__��


��7������C��F����ľ����ṹ����ͼ���������ж϶�Ӧ��ͼ��������F�ľ����У�����þ������ܶ�Ϊag/cm3�������ӵ�������ֵΪNA�� Fԭ�ӵ�Ħ������ΪM g/mol�����ʾFԭ�Ӱ뾶�ļ���ʽΪ______________pm(�г���ʽ���ɣ����ػ���)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����F��Cl��Br��I˳���������
A. ��Χ����B. ԭ�Ӱ뾶C. �縺��D. ��һ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ��ϩ��������ϩ���ʵ�װ����ͼ����ش��й�������
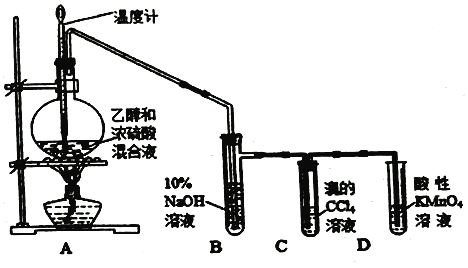
��1����ƿ�г���Ӧ�����⣬��Ӧ��2-3�����Ƭ��Ŀ����___________��
��2����ƿ�в�����ϩ�ķ�Ӧ����ʽΪ____________��
��3����Ӧ��ʼ�ɹ۲쵽C��D�й�ͬ��������___________��C�еķ�Ӧ����Ϊ________��D�еķ�Ӧ����Ϊ____________��Ӧ��
��4����Ӧ������ȴ�����£�������ƿ�з�Һ���֣���ӦҺ��ڡ�����ǿ�ҵĴ̼�����ζ���壬��ԭ����___________��
��5��10%��NaOH��Һ���������___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������У����ж�������ţ�
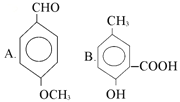
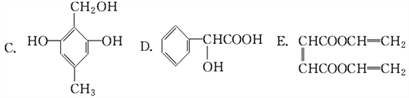
��1�����Կ���������ǣ������ţ���ͬ��________________��
��2�����Կ����������_________________��
��3�����Կ������������_________________��
��4�����Կ����������_________________��
��5�����Կ���ȩ�����_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������ͼװ�ý���ʵ�飬֤����ͭ��ϡ���ᷴӦ������NO��ʵ��ʱ������ע�����ڼ���һ������ϡ���ᣬ�ž�ע�����ڵĿ�����Ѹ�ٽ�����ͭ˿����Ƥñ���ϣ�һ��ʱ���ע����������ɫ���������

��1��ͭ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ_________________��
��2��NO�Ǵ�����Ⱦ��֮һ��Ŀǰ��һ��������������400�����ҡ��д������ڵ�����£��ð�����NO��ԭΪ������ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ4NH3+6NO![]() 5N2+6H2O��ÿ��5 mol N2���ɣ����������뻹ԭ��������ʵ���֮��Ϊ__________��
5N2+6H2O��ÿ��5 mol N2���ɣ����������뻹ԭ��������ʵ���֮��Ϊ__________��
��3����������ϡ���ỻ��Ũ���ᣬ�����ɵ�����ͨ��ˮ�У���������ˮ��Ӧ�Ļ�ѧ����ʽΪ______________________________________________��
��4����д��ʵ������NH4Cl��Ca(OH)2������ȡ�����Ļ�ѧ����ʽ__________��
��������Ȫʵ�飬����ˮ�м����̪���õ���ɫ��Ȫ����ʵ�������˰�����������Ҫ���ʷֱ���________________________��___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֤�����淴ӦN2+3H2![]() 2NH3�Ѵﵽƽ��״̬���ǣ� ��
2NH3�Ѵﵽƽ��״̬���ǣ� ��
��һ��N��N�����ѵ�ͬʱ����6��N��H������
��v��H2��=0.6molL��1min��1��v��NH3��=0.4molL��1min��1
������������������ʱ����ϵѹǿ���ٸı䣻
��NH3��N2��H2��������������ٸı䣻
�����º���ʱ����������������ֲ�����
A�� �ڢۢ� B�� �٢ڢ� C�� �٢ۢ� D�� �ۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com