
| A��0.01 mol��L��1��ˮ��0.01 mol��L��1����������ϣ�������Һ��c(H+)��c(OH��) |
| B����ˮ������Ũ�ȴ�С��ϵ�ǣ�c(H+)��c(Cl��)��c(OH��)��c(ClO��) |
| C��25��ʱ����pH��a�Ĵ�����Һϡ��10������Һ��pH��b����a��b |
D��25��ʱ�� ��0.1 mol��L��1����Һ�У�Na+��CO32����Cl��һ���ܴ������� ��0.1 mol��L��1����Һ�У�Na+��CO32����Cl��һ���ܴ������� |
 ��
��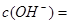 0.1 mol��L��1����ҺΪ������Һ���ڼ�����Һ��Na+��CO32����Cl��֮�䲻��Ӧ��һ���ܴ������档
0.1 mol��L��1����ҺΪ������Һ���ڼ�����Һ��Na+��CO32����Cl��֮�䲻��Ӧ��һ���ܴ������档


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��a>b | B��a=10��4b�� | C��b��10��4a | D��a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A������������Ա�̼�������� NaHS��Һ�У� c��Na+����c��HS������c��H+����c��OH���� |
| B�����������ʵ���Ũ����ͬ��NH4Cl��NH3��H2O�����ҺpH��7������pH=7��NH4Cl��NH3��H2O�����Һ�У�c��NH4+����c��NH3��H2O�� |
| C��Na2HPO4��Һ�У�c��H+�� + c��H2PO4-�� + 2c��H3PO4�� ="=" c��PO43-�� + c��OH-�� |
| D��5mL0��1mol/LAgNO3��Һ��1mL 0��1mol/LAlCl3��Һ��Ϻ����Һ�У� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 H����OH�����ڲ�ͬ�¶��������ӻ�ΪKW(25��)��1.0��10��14�� KW(35��)��2.1��10��14��������������ȷ����
H����OH�����ڲ�ͬ�¶��������ӻ�ΪKW(25��)��1.0��10��14�� KW(35��)��2.1��10��14��������������ȷ����| A��c(H��)���¶ȵ����߶����� | B��35��ʱ��c(H��)>c(OH��) |
| C����Һ��pH(35��)>pH(25��) | D��ˮ�ĵ��������ȵĹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��

| A��ԭ�����Һ�е�CO2-3��AlO��2�����ʵ���֮��Ϊ1:2 |
| B��V1��V2=l��5 |
| C��M��ʱ���ɵ�CO2Ϊ0.05mol |
| D��a���߱�ʾ�����ӷ���ʽΪ��AlO��2+H++H2O=Al(OH)3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A�������£�ϡ��0��1 mol��L�İ�ˮ����Һ��c��OH-����c��NH4+����c��H+�����½� |
| B�������£�c��NH4+����ȵĢ٣�NH4��2SO4�ڣ�NH4��2Fe��SO4��2��NH4Cl�ܣ�NH4��2CO3��Һ�У��������ʵ���Ũ�ȴ�С��ϵ�ǣ���<��<��<�� |
| C��0��1 mol��L NH4HSO4��Һ��0��1mol��L NaOH��Һ�������Ϻ���Һ������Ũ�ȹ�ϵΪ��c��Na+��=c��SP42-��>c��H+��>c��NH4+��>c��OH-�� |
| D������Һ�д��ڵ�����ֻ��Cl-��OH-��NH4+��H+ʱ������Һ������Ũ�ȴ�С��ϵ����Ϊ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A��һԪǿ�� | B����Ԫǿ�� | C���κ�ǿ�� | D������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A����ˮ���Ȼ�淋Ļ��Һ����pH=7ʱ��c��Clһ��>C��NH4+�� |
| B��pH=2��һԪ���pH=12��NaOH��Һ��������,���Һ��C��H+��һ�� ����C��OH-�� |
| C��0.1mol��L��Na2S��Һ�У�C��OH����=c��H+��+C��HS����+2C��H2S�� |
| D��0.1mol��LNaCl��Һ��0.1mol/LNaF��Һ����������Ũ��һ����� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com