
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
分析 ①利用试管可发生固体与液体的反应制取氢气;
②利用溶解、过滤、蒸发提纯粗盐;
③在试管中加热可发生氢气还原CuO的反应;
④称量后,在烧杯中溶解即可.
解答 解:①制取氢气可用试管、铁架台、带导管的橡皮塞、集气瓶、玻璃片,这些仪器都有,故能完成,故不选;
②粗盐提纯要经过溶解、过滤、蒸发等操作,过滤时要用到漏斗,蒸发时要用到蒸发皿而所给仪器中没有,故选;
③用氢气还原氧化铜要用到酒精灯、试管、铁架台、导管、橡皮塞,这些仪器都有,故能完成,故不选;
④用固体物质配制一定质量分数溶液的步骤是计算、称量、溶解,称量中要用到托盘天平,溶解要用到烧杯,玻璃棒,缺少天平,故不能完成,故选;
故选D.
点评 本题考查化学实验方案的评价,为高频考点,把握性质实验、混合物分离提纯实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
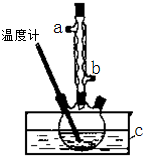 正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):
正丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3)是一种化工原料,常温下为无色液体,不溶于水,沸点为142.4℃,密度比水小.某实验小组利用如下装置合成正丁醚(其它装置均略去):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 遇氯化氢产生白烟 | B. | 能使湿润的蓝色石蕊试纸变红 | ||
| C. | 刺激性气味、密度比空气小 | D. | 其水溶液能使酚酞溶液变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com