
请回答下列问题:
(1)制备硅半导体材料必须先得到高纯硅。三氯甲硅烷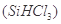 还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
还原法是当前制备高纯硅的主要方法,生产过程示意图如下: 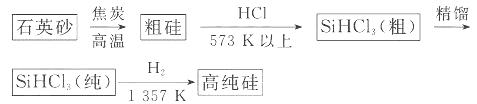
①写出由纯 制备高纯硅的化学方程式: ____________________________________。
制备高纯硅的化学方程式: ____________________________________。
②整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成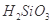 、HCl和另一种物质,配平后的化学反应方程式为___________________________;
、HCl和另一种物质,配平后的化学反应方程式为___________________________;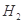 还原
还原 过程中若混入
过程中若混入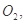 可能引起的后果是____________________________________。
可能引起的后果是____________________________________。
(2)下列有关硅材料的说法正确的是_________ (填字母)。
| A.碳化硅化学性质稳定,可用于生产耐高温水泥 |
| B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承 |
| C.高纯度的二氧化硅可用于制造高性能通讯材料——光导纤维 |
| D.普通玻璃是由纯碱、石灰石和石英砂制成的,其熔点很高 |
(1)①
 Si+3HCl
Si+3HCl
②

 ↑ 发生爆炸
↑ 发生爆炸
(2)BC
(3)有白色胶状沉淀生成,反应原理为 Na2SiO3 + 2HNO3 = H2SiO3↓+ 2NaNO3
解析试题分析:(1)①根据原子守恒即质量守恒可以写出SiHCl3与H2反应的化学方程式。
②SiHCl3和H2O剧烈反应生成H2SiO3、HCl和另一种物质,分析它们化合价的变化可知,  ,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。
,而Cl的化合价未发生变化,因此另一种元素即H元素的化合价必定降低,即另一种物质是H2。
(2)SiC和Si3N4均为原子晶体,熔点高,性质稳定,A、B正确。光导纤维的材料为SiO2,C正确。玻璃是一种玻璃态物质,无固定的熔点。盐酸不能与硅反应,而HCl在573 K以上的温度下可与硅发生反应。因此D、E都不正确。
(3)有白色胶状沉淀生成,HNO3的酸性大于硅酸,所以发生反应:Na2SiO3 + 2HNO3 = H2SiO3↓+ 2NaNO3。
考点:本题考查硅单质及其化合物的性质及其应用、化学方程式的书写、实验现象的描述。


科目:高中化学 来源: 题型:填空题
离子化合物AB2的阴、阳离子的电子层结构相同,1 mol AB2中含54 mol电子,且有下列反应:
①H2+B2 C
C
②B2+X→Y+AB2+H2O
③Y+C→AB2+Z,Z有漂白作用。
根据上述条件回答下列问题:
(1)写出下列物质的化学式:AB2__________,X________,Y________,Z________。
(2)用电子式表示AB2的形成过程:_____________________________________________。
(3)写出反应②的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硅及其化合物对人类现代文明的发展具有特殊贡献。请回答下列有关问题:
(1)硅原子的结构示意图:________。
(2)下列物品或设备所用的材料属于硅酸盐的是________。
①长江三峡水泥大坝 ②石英光导纤维 ③陶瓷坩埚
④普通玻璃 ⑤硅太阳能电池
| A.①②⑤ | B.③④⑤ | C.②③④ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
“蛇纹石石棉”主要成分有二氧化硅、氧化镁和结晶水,它的化学式是Mg6[(OH)4Si2O5]2。
(1)“蛇纹石石棉”的氧化物形式为______________________,其中原子半径最大的元素
在周期表中的位置是______________________。
(2)Si原子的最外层的电子排布式为_____________,SiO2与NaOH溶液反应的化学方程式
为________________________________________________。
(3) SiCl4比SiO2的熔点_____(填“低”、“高”),原因是__________________________。
(4)从哪些方面不能判断Si和O的非金属性强弱 。
| A.利用Si和O在周期表中的位置 |
| B.SiO2与水不发生反应 |
| C.Si在一定条件下与氧气反应,生成SiO2 |
| D.H2SiO3的酸性比H2O的酸性强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
喷泉是一种常见的自然现象,其产生的原因是存在压强差。制取氨气并完成喷泉实验(图中夹持装置均已略去)。
(1)写出实验室制取氨气的化学方程式: _________ 。
(2)收集氨气应使用 法。
(3)要得到干燥的氨气可选用下列 做干燥剂。
| A.浓硫酸 | B.碱石灰 | C.NaOH固体 | D.P2O5固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol·L﹣1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH_______7(填“=”“>”或“<”)。
(2)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明________(填字母)
| A.该Na2S2O3溶液中水电离的c(OH﹣)=10﹣8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
| D.Na2S2O3水解方程式为S2O32﹣+2H2O=H2S2O3+2OH﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。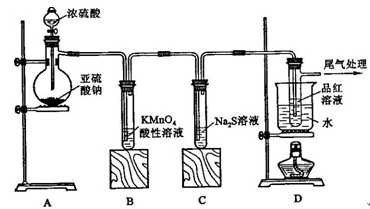
请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气在科技、生产中应用广泛。
(1)工业上常用熟石灰和氯气反应制取漂白粉,化学方程式是 。
(2)实验室用MnO2与浓盐酸反应制取氯气的原理如下:MnO2 + 4HCl MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
①若制取11.2 L Cl2(标准状况),则最少应加入MnO2的质量为______g。
②用平衡移动原理解释可用排饱和食盐水法收集氯气的原因 。(结合必要的化学用语及文字回答)
③制备氯气时,可用NaOH溶液吸收尾气,下列试剂也可用于吸收氯气的是____(填字母)。
a. KI溶液 b. FeCl2溶液 c. KCl溶液
写出你选择的吸收试剂与Cl2反应的离子方程式:_______。
④也可用浓氨水吸收氯气,同时生成一种无污染的气体,反应的化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是 。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。
将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是 。处理从氯化塔中逸出气体的方法是 。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是 ,其原因可能是 ,由此可知(2)中氯化塔设计为四层是为了减少生产中类似副反应的发生。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com