黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将m1 g该黄铁矿样品放入如图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2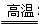 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
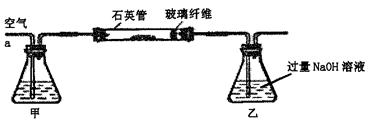
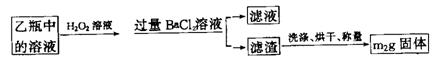
Ⅱ、反应结束后,将乙瓶中的溶液进行如下处理:
| 2
(1)氢氧化钠(或氢氧化钾) (2分) SO2+2OH-=SO32-+H2O;2SO32-+O2=2SO42- (2分) (2)使SO32-完全氧化为SO42- (2分) (3)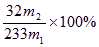 (3分) (3分) (4)不合理(1分)会使所测得的铁元素的质量分数偏大(2分) (5)250ml容量瓶(2分)
练习册系列答案
相关习题
科目:高中化学
来源:2007年普通高等学校招生全国统一考试、化学(广东卷)
题型:038
|
|
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4.
| (1) |
|
将0.050molSO2(g)和0.030molO2(g)放入容积为1L的密闭容器中,反应:2SO2(g)+O2(g) 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程). 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040mol/L.计算该条件下反应的平衡常数K和SO2的平衡转化率(写出计算过程).
|
|
(2) |
|
已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有________(填字母)
A、升高温度
B、降低温度
C、增大压强
D、减小压强
E、加入催化剂
F、移出氧气
|
|
(3) |
|
SO2尾气用饱和Na2SO3溶液吸收可得到更要的化工原料,反应的化学方程式为________.
|
|
(4) |
|
将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4.酸溶过程中需保持溶液足够酸性,其原因是________.
|
|
|
查看答案和解析>>
科目:高中化学
来源:
题型:
黄铁矿(主要成分为FeS 2)是工业制取硫酸的重要原料,其煅烧产物为SO 2和Fe 3O 4。 (1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1 L的密闭容器中,反应:2SO2(g)+O2(g)  2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol·L-1。计算该条件下SO2的平衡转化率(写出计算过程)。 2SO3(g)在一定条件下达到平衡,测得c(SO3)=0.040 mol·L-1。计算该条件下SO2的平衡转化率(写出计算过程)。 (2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高SO2平衡转化率的有___________(填字母)。 A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出氧气 (3)SO2尾气用饱和Na2SO3溶液吸收可得到更重要的化工原料,反应的化学方程式为___________________________。 (4)将黄铁矿的煅烧产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是_______________________________________________________。
查看答案和解析>>
科目:高中化学
来源:2013-2014学年四川省眉山市高三第一次诊断性考试化学试卷(解析版)
题型:填空题
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下:

查资料得知:
|
物质名称
|
溶度积(Ksp)
|
pH值
|
|
开始沉淀
|
完全沉淀
|
|
Mg(OH)2
|
5.6×10-12
|
9.3
|
10.8
|
|
Fe(OH)3
|
2.8×10-16
|
2.7
|
3.7
|
|
Al(OH)3
|
1.3×10-33
|
3.7
|
4.7
|
请回答下列问题:
(1)写出固体A的化学式为
。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液
B.广泛pH试纸
C.精密pH试纸
D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G
。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为
。
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。
查看答案和解析>>
科目:高中化学
来源:同步题
题型:填空题
黄铁矿(主要成分为FeS2)是工业制取硫酸的重要原料,其煅烧产物为SO2和Fe3O4。
(1)将0.050 mol SO2(g)和0.030 mol O2(g)放入容积为1L的密闭容器中,反应在一定条件下达到平衡,测得
c(SO3)= 0. 040 mol/L。计算该条件下反应的平衡常数K 和SO2的平衡转化率(写出计算过程)。
(2)已知上述反应是放热反应,当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高 SO2平衡转化率的有____(填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强 E.加入催化剂 F.移出氧气
(3)SO2尾气用饱和Na2SO3溶液吸收可得到重要化工原料,反应的化学方程式为___________________。
(4)将黄铁矿的燃料产物Fe3O4溶于H2SO4后,加入铁粉,可制备FeSO4。酸溶过程中需保持溶液足够酸性,其原因是__________________________。
查看答案和解析>>
科目:高中化学
来源:
题型:
化学工业在国民经济中占有极其重要的地位,江苏省是国内最早的硫酸生产基地之一。主要方程式和主要设备: (黄铁矿的主要成分为FeS2) 4FeS2+11O2 = 2Fe2O3+8SO2 (沸腾炉) 2SO2+O2 2SO3 (接触室) SO3+H2O=H2SO4(吸收塔) 2SO3 (接触室) SO3+H2O=H2SO4(吸收塔) (1)硫酸生产中,根据化学平衡原理来确定的条件或措施有 (填写序号)。 A.矿石加入沸腾炉之前先粉碎 B.接触室的反应使用V2O5作催化剂 C.接触室中不使用很高的温度 D.净化后炉气中要有过量的空气 E.接触室中的氧化在常压下进行 F.吸收塔中用98.3%的浓硫酸吸收SO3 (2)0.1mol/L的NaHSO3溶液中,有关粒子浓度由大到小的顺序为: c (Na+)>c (HSO3-)>c (SO32-)>c (H2SO3) ①该溶液中c (H+) c (OH-)(填“>”、“=” 或“<” ),其理由是(用离子方程式表示): 。 ②现向NaHSO3溶液中,逐滴加入少量含有酚酞的NaOH溶液,可观察到的现象是 ,反应的离子方程式为: 。
查看答案和解析>>
| |

![]() 2Fe2O3 + 8SO2
2Fe2O3 + 8SO2
