
�ҹ��س�ʯ��KAlSi3O8������Դ�ȽϷḻ����ҵ�Ͽ���ʳ�κͼس�ʯ��һ���������Ʊ��Ȼ��أ�NaCl (l) ��KAlSi3O8 (s)  KCl (l)��NaAlSi3O8 (s)��
KCl (l)��NaAlSi3O8 (s)��
���������գ�
23����ԭ�ӵ���������ռ���� ��������� ��������
24���Ȼ��Ƶ��۵���Ȼ��ص� ����ߡ��͡�����ԭ���� ��
25���ѷ�Ӧ���漰��������Ԫ�ص�ԭ�Ӱ뾶����С�����˳������ ��
26������������Ӧ��λ��ͬһ���ڵļ���Ԫ���У���һ��Ԫ�ص�����������ˮ���������Ԫ�ص�����������ˮ������ܷ�����Ӧ������Ԫ���� ��
27��Ϊ�о�������Ӧ�м�Ԫ�ص��۳��ʣ�Һ���м�Ԫ�ص�����ռȫ����Ԫ�������İٷ��ʣ����¶ȵĹ�ϵ������ʵ�飨�Ȼ�����س�ʯͶ�ϵ�������Ϊ2:1��������������ݣ�
|
��Ԫ�� �¶� �۳��� | 1.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| 830�� | 0.481 | 0.575 | 0.626 | 0.669 | 0.685 |
| 890�� | 0.579 | 0.691 | 0.694 | 0.699 | 0.699 |
| 950�� | 0.669 | 0.714 | 0.714 | 0.714 | 0.714 |
��1���������ݿ��Եó������Ʊ��Ȼ��صķ�Ӧ�� ������ȡ������ȡ�����Ӧ��
��2������890��ʱ���Ȼ��Ƶ�ƽ��ת���� ��(ʽ����KAlSi3O8�C278 NaAlSi3O8 �C262)
��3��950��ʱ������۳��ص����ʿ��Բ�ȡ�Ĵ�ʩ�� ��д�����֣���
 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ����ȷ���� �� ��
A������������������ˮ��Һ�еķ�Ӧ��CH3CH2Br + OH-  CH3CH2OH +Br -
CH3CH2OH +Br -
B��������Һ��������ͭ��Ӧ��2CH3COOH + Cu(OH)2 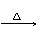 Cu2+ + 2CH3COO-+ 2H2O
Cu2+ + 2CH3COO-+ 2H2O
C����������Һ��ͨ������������̼��2C6H5O��+ CO2 + H2O  2C6H5OH + CO32-
2C6H5OH + CO32-
D����ȩ��Һ��������������Һ����
HCHO+4[Ag(NH3)2]++4OH�� 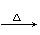 CO32-+2NH4+ +4Ag��+6NH3+2H2O
CO32-+2NH4+ +4Ag��+6NH3+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ж��л���ṹ�����ʵ������д�����ǣ�������
A��һ�������£�Cl2���ڼױ��ı���������Ϸ���ȡ����Ӧ
B������ͱ�ϩ�����ʵ�����1mol�����ȼ������3molH2O
C���ú˴Ź���������1��������2������
D������屽����һ�ֿռ�ṹ��֤���������в����ڵ�˫������Ľṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ʵ������ƽ���ƶ�ԭ�����͵���
|
|
|
| |||||||||||||
| A | B | C | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

48��д����Ӧ��ķ�Ӧ�Լ��ͷ�Ӧ���� ��
49��д����Ӧ���͡���Ӧ�� ��Ӧ�� ��
50��д���ṹ��ʽ��E F ��
51��д��G��M�Ļ�ѧ��Ӧ����ʽ ��
52����Ӧ���ܷ�ʡ�ԣ� ��˵��ԭ�� ��
53����E��F�����������������Ĵ����ܷ�ߵ��� ��˵��ԭ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����˵����ȷ����
A��ͬ��ͬѹ�£�H2 (g)+Cl2(g)= 2HCl(g)�ڹ��պ͵�ȼ�����µġ�H��ͬ
B���κ��������кͷ�Ӧ����1 mol H2O�Ĺ����У������仯����ͬ
C����֪����2H2(g) +O2(g) =2H2O(g) ��H=-a kJ·mol-1,��2H2(g)+O2 (g)= 2H2O(1) ��H=-b kJ·mol-1����a>b
D����֪����C(s��ʯī)+O2 (g)=CO2(g) ��H=- 393.5kJ·mol-1����C(s�����ʯ)+O2(g)=CO2 (g) ��H=- 395.0 kJ·mol-1,��C(s��ʯī)=C(s�����ʯ) ��H= -1.5 kJ·mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ��ҵ�ǹ��õ�֧����ҵ�������������������漰������ԭ��Ӧ����
A�����ʳ��õ����������ϳɰ��� B�����᳧�ð�������������
C���Ӻ�ˮ������ D�������NaCl��NH3��CO2���ƴ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ѷ���Ŀǰ����NH3��ˮ����Ⱦ����Ҫ��������һ�������£���ˮ���м�������NaOH��ʹNH3���ѳ���������ƽ���ƶ�ԭ��������ԭ�� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com