
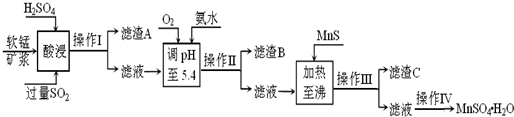
工业上以软锰矿为原料,利用烧结烟气中的SO2制备MnSO4·H2O的流程如下:

某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。酸浸过程发生反应:MemOn+H+→Me(2n/m)++H2O,Me表示Fe、 Al、 Zn、 Cu等。25℃时部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
回答下列问题:
(1)酸浸时SO2将MnO2还原为MnSO4,其离子方程式为 。
酸浸时SO2的吸收率与pH和温度的关系如下图,为提高SO2的吸收率,酸浸适宜的条件是 。


图1: SO2 的吸收率与 pH值的关系 图2: SO2的吸收率与温度的关系
(2)滤渣B的主要成分是 。
(3)加入MnS的目的是 。
(4)操作IV的步骤为 、 、过滤、洗涤、干燥。
(5)MnO2的生产方法之一是以石墨为电极,在不断搅拌情况下,电解酸化的MnSO4溶液,阳极的电极反应式为: 。
(6)已知金属离子浓度小于1.0×10-5mol/L时认为已经完全沉淀,根据表格数据,计算25℃时Zn(OH)2溶度积Ksp为 (不需计算过程,计算结果保留两位有效数字)。
(17分)
(1) MnO2 +SO2= Mn2++SO42-(3分) pH为3左右、温度为40℃左右(2分)
(2)Fe(OH)3、Al(OH)3 (2分)
(3)除去Cu2+、Zn2+ (2分)
(4)蒸发浓缩 冷却结晶 (2分)
(5)Mn2+-2e-+2H2O = MnO2+ 4H+ (3分)
(6)1.0×10-17 (3分)
【解析】
试题分析:(1)依题意,二氧化硫是还原剂,二氧化锰是氧化剂,硫酸根离子是氧化产物,锰离子是还原产物,根据元素化合价升降的最小公倍数、电荷和原子个数守恒法配平可得:MnO2 +SO2= Mn2++SO42-;读图可知,其它变量保持不变时,酸浸溶液pH为3左右时,二氧化硫的吸收率最大;其它变量保持不变时,酸浸溶液温度为40℃左右时,二氧化硫的吸收率最大;为了提高二氧化硫的吸收率,酸浸适宜的条件是pH为3左右、温度为40℃左右;(2)酸浸时,二氧化锰被二氧化硫氧化,所得硫酸锰溶于水,而铁的氧化物、铝的氧化物、锌的氧化物、铜的氧化物均溶于硫酸,只有硅的氧化物不溶于硫酸和水,则滤渣A的主要成分是二氧化硅;操作I是过滤,所得滤液主要含有Mn2+、Fe2+、Fe3+、Al3+、Cu2+、Zn2+、SO42-、H+,酸性条件下通入氧气的目的是除去Fe2+,使亚铁离子完全氧化为铁离子且消耗溶液中的氢离子,发生的反应为4Fe2++O2+4H+=4Fe3++2H2O,通入氨水中和过量的酸,NH3•H2O+H2SO4=(NH4)2SO4,使溶液的pH增大;读表中金属阳离子以氢氧化物形式完全沉淀时的pH可得,若调pH至5.4,使Fe3+、Al3+完全沉淀,生成Fe(OH)3、Al(OH)3,则滤渣B的主要成分是Fe(OH)3、Al(OH)3,操作II是过滤,所得滤液的pH约为5.4,主要含有Mn2+、Cu2+、Zn2+、SO42-、NH4+、H+;(3)读表格中金属阳离子以硫化物形式完全沉淀时的pH可得,向pH约为5.4的滤液中加入MnS,加热煮沸时,可以除去Cu2+、Zn2+,且引入Mn2+,既除去杂质又不引入新的杂质;(4)操作III是过滤,滤渣C的主要成分是CuS、ZnS;所得滤液的pH约为5.4,主要含有Mn2+、SO42-、NH4+、H+,从该溶液中分离出MnSO4•H2O的方法是结晶,主要步骤是蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(5)阳极发生氧化反应,反应物中所含元素的化合价升高,由此推断阳极的主要反应物是Mn2+,主要产物是MnO2,根据化合价升高总数等于失去电子数,根据酸性溶液中用氢离子和水使左右电荷、原子守恒,可以书写并配平该阳极反应式:Mn2+-2e-+2H2O
= MnO2+ 4H+;(6)氢氧化锌是难溶电解质,存在如下平衡: Zn(OH)2(s) Zn2++2OH-,由于表中氢氧化锌完全沉淀时溶液pH=8.0,25℃时Kw=1.0×10-14,则该溶液中c(H+)=1.0×10-8mol/L,c(OH-)=Kw/ c(H+)=10-6mol/L,由于此时溶液c(Zn2+)=1.0×10-5mol/L,则Ksp[Zn(OH)2(s)]=
c(Zn2+)• c2(OH-)=
1.0×10-17,注意保留两位有效数字。
Zn2++2OH-,由于表中氢氧化锌完全沉淀时溶液pH=8.0,25℃时Kw=1.0×10-14,则该溶液中c(H+)=1.0×10-8mol/L,c(OH-)=Kw/ c(H+)=10-6mol/L,由于此时溶液c(Zn2+)=1.0×10-5mol/L,则Ksp[Zn(OH)2(s)]=
c(Zn2+)• c2(OH-)=
1.0×10-17,注意保留两位有效数字。
考点:考查物质制备工艺流程,涉及二氧化硫的还原性、二氧化锰的氧化性、氧化还原反应、离子方程式、二氧化硫吸收率与酸浸溶液pH和温度的关系、滤渣B的主要成分、晶体制备的操作步骤、电解法制备二氧化锰的阳极反应式、氢氧化锌沉淀完全时溶液的pH与水的离子积的计算、氢氧化锌溶度积的计算等。


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 |
| 沉淀物 | CuS | ZnS | MnS | FeS | ||
| Ksp | 8.5×10-45 | 1.2×10-23 | 1.4×10-15 | 3.7×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Pb(OH)2 | Mn(OH)2 | PbS | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 8.7 | 10.4 | ≥0.1 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
Mn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | ≥-0.42 | ≥2.5 | ≥7 | ≥7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(07年广东化学·24)(10分)

二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 | Zn(OH)2 | CuS | ZnS | MnS | FeS |
| pH | 5.2 | 3.2 | 9.7 | 10.4 | 6.7 | 8.0 | ≥–0.42 | ≥2.5 | ≥7 | ≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为 。
(2)滤渣A的主要成分是 。
(3)加入MnS的目的是除去 杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为 。
(5)从废旧碱性锌锰电池中可以回收利用的物质有 (写出两种)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com