
| A. | c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | B. | c(Na+)>c(OH-)>c(CH3COO-)>c(H+) | ||
| C. | c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | D. | c(Na+)+c(OH-)=c(CH3COO-)+c(H+) |
分析 用0.100 0 mol•L-1NaOH溶液滴定20.00 mL 0.1 000 mol•L-1CH3COOH溶液,当滴入NaOH溶液为20.00 mL时,两溶液恰好反应生成醋酸钠,溶液显碱性,则c(OH-)>c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-)可知:c(Na+)>c(CH3COO-),据此进行解答.
解答 解:用0.100 0 mol•L-1NaOH溶液滴定20.00 mL 0.1 000 mol•L-1CH3COOH溶液,当滴入NaOH溶液为20.00 mL时,反应后溶质为CH3COONa,
A.反应后溶液呈碱性,则c(OH-)>c(H+),故A错误;
B.醋酸根离子的水解程度较小,则c(CH3COO-)>c(OH-),故B错误;
C.根据溶液中的电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C正确;
D.CH3COO-水解导致c(Na+)>c(CH3COO-),溶液呈碱性则c(OH-)>c(H+),所以c(Na+)+c(OH-)>c(CH3COO-)+c(H+),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确反应后溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理的含义及应用方法,试题有利于培养学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
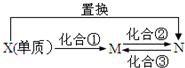 M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )
M、N为含X元素的常见化合物,它们之间有如图的转化关系.下列说法正确的是( )| A. | X可以是Mg或Cu元素 | |
| B. | 化合②③的反应可以是非氧化还原反应 | |
| C. | 若X为C元素,则该转化关系中X单质发生的置换反应可以是2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO | |
| D. | 若X为Fe元素,则M的H218O溶液中加入固体Na2O2的反应为:4Fe3++6H218O+6Na2O2═4Fe(OH)3↓+12Na++318O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增加C的量 | |
| B. | 将容器的体积缩小一半 | |
| C. | 保持体积不变,充入一定量的H2O(g) | |
| D. | 保持压强不变,充入N2使容器体积变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | c | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同主族元素从上到下,单质的熔点逐渐降低 | |
| B. | 同周期主族元素离子半径从左到右依次减小 | |
| C. | HF、HCl、HBr、HI 的热稳定性依次减弱,还原性和水溶液的酸性依次增强 | |
| D. | 第三周期非金属元素含氧酸的酸性从左到右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
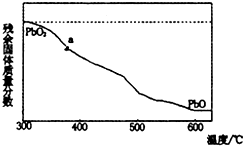 (1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3
(1)某小组分析二氧化铅分解产物的组成,取478g的PbO2加热,PbO2在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a为96.66%,则a点固体的分子式为Pb2O3查看答案和解析>>
科目:高中化学 来源: 题型:解答题
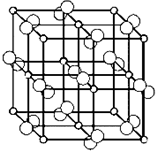 四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位.回答下列问题:
四川含有丰富的矿产资源,钒矿、钛矿、黄铁矿等七种矿产储量位居全国第1位.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com