
25℃时,体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液均匀混合后,溶液的pH=7,已知b=6a,Va<Vb,下列有关a的说法中正确的是( )
A.a可能等于1 B.a一定大于2
C.a一定小于2 D.a一定等于2
科目:高中化学 来源:2015-2016学年江西省高二下期中化学试卷(解析版) 题型:实验题
实验室用少量的溴水和足量的乙醇制备1,2-二溴乙烷的装置如下图所示:
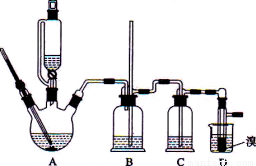
有关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -l30 | 9 | -1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式_____________________。
(2)装置B的作用是_____________________。
(3)在装置C中应加入___________(填字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(4)若产物中有少量未反应的Br2,最好用________(填字母)洗涤除去。
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚.可用_______________的方法除去。
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是_______________。
(7)判断该制备反应已经结束的最简单方法是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三第五次模拟理综化学试卷(解析版) 题型:填空题
Q、R、T、W、X、Y、Z为原子序数依次增大的前四周期元素,其中R、T、W是同周期相邻元素,Q、R最外层电子排布可表示为asa,bsbbpa(a≠b):X的基态原子中占据哑铃形原子软道的电子数为10,Y与X为同周期主族元素,基态Z原子核外电子填充在7个能级中,且价层电子有3对成对电子。
(1)四种分子①RY3②TQ4③WQ3④Q2X键角由大到小排列的顺序是_____________(填序号).
(2)微粒W3-的空间构型为_____________。
(3)XTW-的等电子体中属于分子的有_____________(填化学式,写出一种即可),XTW-的电子式为_____________;
(4)R的某种钠盐晶体,其阴离子Mm-(含Q、R、O三种元素)的球棍模型如下图所示:在Mm-中,R原子轨道杂化类型为_____________,m=_____________。(填数字)

(5)T的某种单质的片层与层状结构如图1所示.其中层间距离为xpm,图2为从结构中取出的晶胞,若晶胞的边长为ypm,则T的该种单质的密度为_____________g•cm-3。(1pm=10-12m)

查看答案和解析>>
科目:高中化学 来源:2016届湖北省黄冈市高三5月一模理综化学试卷(解析版) 题型:选择题
自然界中金属硫化物之间存在原电池反应。下图所示装置中电极Ⅰ为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转。若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀。下列有关说法中正确的是( )

A.工业上利用该原理富集铁
B.电极Ⅱ作正极
C.溶液流经该装置后pH增大
D.该装置负极的电极反应为FeS2—15e—+8H2O=Fe3++2SO42—+16H+
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:填空题
(1)某学生用已知物质的量浓度的盐酸来测定未知浓度的氢氧化钠溶液时,选择甲基橙作指示剂,下列操作中可能使所测氢氧化钠溶液浓度偏大的是_____。
A.酸式滴定管未用标准盐酸润洗,直接装入标准盐酸
B.酸式滴定管滴定前有气泡,滴定后气泡消失
C.滴定前盛放氢氧化钠溶液的锥形瓶用蒸馏水洗净后未干燥
(2)常温下0.1 mol·L-1的CH3COOH溶液加水稀释过程中,下列表达式的数据一定变小的是________。
A.c(H+) B.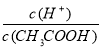
C.c(H+)·c(OH-) D.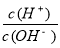
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1 000 mL,稀释过程pH变化如图。则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数;稀释后,HX溶液中水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸溶液中水电离出来的c(H+)。
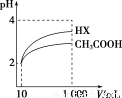
(4) 体积均为10 mL pH=2的醋酸溶液与一元酸HX溶液分别与等浓度的氢氧化钠溶液反应,消耗氢氧化钠溶液的体积,醋酸溶液 ________一元酸HX溶液(填“大于”、“等于”或“小于”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
在密闭容器中,一定条件下,进行如下反应:NO(g)+CO(g) 1/2N2(g)+CO2(g)ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
1/2N2(g)+CO2(g)ΔH=-373.2 kJ·mol-1,达到平衡后,为提高该反应的速率和NO的转化率,采取的正确措施是( )
A.加催化剂同时升高温度 B.加催化剂同时增大压强
C.升高温度同时充入N2 D.降低温度同时增大压强
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古杭锦后旗奋斗中学高二下期中化学卷(解析版) 题型:选择题
在100 mL 0.1 mol·L-1的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )
A.加热
B.加入100 mL 0.1 mol·L-1的醋酸溶液
C.加入少量的0.5 mol·L-1的硫酸
D.加入少量的1 mol·L-1的NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2016届山西省等校高三下第四次联考理综化学A卷(解析版) 题型:实验题
钛是一种重要的金属,以钛铁矿[主要成分为钛酸亚铁(FeTiO3),还含有少量Fe2O3]为原料制备钛的工艺流程如图所示:
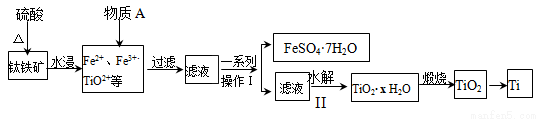
(1)钛铁矿与硫酸反应的化学方程式为 。
(2)加入的物质A为 。
(3)步骤Ⅱ中发生反应的离子方程式为 ;水解过程中需要升高温度,其目的是:①加快反应水解速率 ② 。
(4)由TiO2获得金属Ti可用以下两种方法。
①电解法:以石墨为阳极,TiO2为阴极,熔融CaO为电解质,其阴极的电极反应式为 。
②热还原法:首先将TiO2、氯气和过量焦炭混合,高温反应生成TiCl4;然后用Mg还原TiCl4即可制取Ti。生成TiCl4的反应中,氧化剂与还原剂的物质的量之比为 ;生成Ti的反应需在Ar气氛中,其原因为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆兵团农二师华山中学高二下期中化学卷(解析版) 题型:填空题
T ℃时,A气体与B气体反应生成C气体,反应过程中A、B、C浓度变化如图(Ⅰ)所示,若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示。
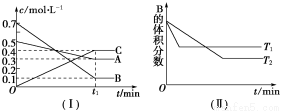
根据以上条件,回答下列问题:
(1)A与B反应生成C的化学方程式为 ,正反应为________(填“吸热”或“放热”)反应。
(2)在密闭容器中,加入2 mol A和6 mol B。
① 当反应达到平衡时, A和B的浓度比是_______;A和B的转化率之比是_______。
② 升高平衡体系的温度(保持体积不变),混合气体的平均相对分子质量________。(填“变大”、“变小”或“不变”)
③ 当达到平衡时,充入氩气,并保持压强不变,平衡将____(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com