
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素原子形成简单离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
根据原子结构及元素周期律的知识,下列推断正确的是
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl‾、S2‾、Ca2+、K+半径逐渐减小 D.35Cl2与37Cl2得电子能力相同
查看答案和解析>>
科目:高中化学 来源: 题型:
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在放电过程中的总反应方程式是:NiOOH + MH === Ni(OH)2 + M,下列说法错误的是
A.放电过程中负极的电极反应式:MH + OH--e-=== H2O + M
B.放电过程中OH-从正极向负极迁移
C.放电时若有1 mol M生成,则转移的电子数目为NA (NA为阿伏伽德罗常数的值)
D.NiMH电池中不能用KOH溶液作为电解质溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
氯气是一种重要的化工原料。某学习小组在实验室中利用下图所示装置制取氯气并探究其性质。
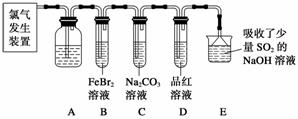
(1)实验室用二氧化锰和浓盐酸加热制取氯气,该反应的离子方程式为____________________________________________________________。
(2)装置A中盛有的试剂是饱和NaCl溶液,作用是_______________________________。
(3)若D中品红溶液褪色,则B装 置中发生反应的离子方程式是_____________________________________________________________。
置中发生反应的离子方程式是_____________________________________________________________。
某研究性学习小组用刚吸收过少量SO2的NaOH溶液吸收处理上述实验后的尾气。经分析吸收尾气一段时间后,吸收液(呈强碱性)中肯定存在Cl-、OH-、CO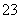 和SO
和SO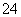 ,对于可能存
,对于可能存 在的其他阴离子,研究小组提出以下3种假设。
在的其他阴离子,研究小组提出以下3种假设。
假设1:只存在SO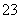 ; 假设2:只存在ClO-;假设3:既不存在
; 假设2:只存在ClO-;假设3:既不存在 SO
SO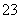 ,也不存在ClO-。
,也不存在ClO-。
(4)学习小组判断同时存在SO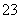 和ClO-是不可能的理由是_____________________。
和ClO-是不可能的理由是_____________________。
(5)现限选以下试剂,设计实验方案,进行实验,请写出实验步骤以及预期现象和结论。
a.3 mol·L-1 H2SO4 b.酸性KMnO4溶液 c.1 mol·L-1 BaCl2溶液
d.FeCl2溶液 e.酚酞试液
步骤一:取少量吸收液于试管中,滴加3 mol·L-1 H2SO4至溶液呈中性,然后将所得溶液分装于F、G两试管中。
步骤二:向F试管中滴加少量__________(填序号),若溶液____________________(填现象),则假设1成立。
步骤三:向G试管中滴加少量d溶液,生成红褐色沉淀,假设2成立,则反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定量纯净的氨基甲酸铵(NH2COONH4)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)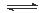 2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
2NH3(g)+CO2(g)。下列可以判断该分解反应已经达到化学平衡状态的是( )
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的平均摩尔质量不变 D.密闭容器中氨气的体积分数不变
查看答案和解析>>
科目:高中化学 来源: 题型:
浙江大学的科研小组成功研制出能在“数分钟之内”将电量充满的锂电池,其成本只有传统锂电池的一半。他们把锂锰
氧化物(LMO)浸泡在石墨里面,使其变成一个可以导电的密集网络的负极材料(如图2—1),与电解质和正极材料(石墨)
构成可充电电池。若电解液为LiAlCl4-SOCl2,电池的总反应为::
4LiCl+S+SO2  4Li+2SOCl2。下列说法正确的是( )
4Li+2SOCl2。下列说法正确的是( )
A.电池的电解液可为LiCl水溶液
B.该电池放电时,负极发生还原反应
C.充电时阳极反应式为:4Cl-+S+SO2-4e-=2SOCl2
D.放电时电子从负极经外电路流向正极,再从正极经电解质流向负极
查看答案和解析>>
科目:高中化学 来源: 题型:
 有 CH3CH2OH、CH3CH2Br、NH4Cl溶液四种无色液体,只用一种试剂就能把它们鉴别开,这种试剂是( )
有 CH3CH2OH、CH3CH2Br、NH4Cl溶液四种无色液体,只用一种试剂就能把它们鉴别开,这种试剂是( )
A.溴水 B.NaOH溶液
C.Na2SO4溶液 D.Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.下图是某煤化工产业链的一部分,试运用所学知识,解决下列问题:
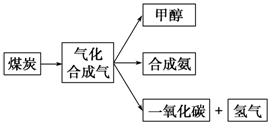
(1)已知该产业链中某反应的平衡常数表达式为
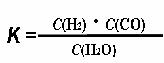 ,它所对应反应的化学方程式是 。
,它所对应反应的化学方程式是 。
(2)合成甲醇的主要反应是2H2(g)+CO(g)  CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如下:
CH3OH(g) ΔH=-90.8 kJ·mol-1,t ℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应10 min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol·L-1) | 0.2 | 0.1 | 0.4 |
①该时间段内反应速率v(H2)=________。
②比较此时正、逆反应速率的大小:v正________v逆(填“>”、“<”或“=”)。
③反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡______(填“逆向”、“正向”或“不”)移动,平衡常数K____________(填“增大”、“减小”或“不变”)。
(3)固氮是科学家致力研究的重要课题。自然界中存在天然的大气固氮过程:
N2(g)+O2(g)===2NO(g) ΔH=+180.8 kJ·mol-1,工业合成氨则是人工固氮。
分析两种固氮反应的平衡常数,下列结论正确的是________________________________
(填字母序号)。
| 反应 | 大气固氮 | 工业固氮 | ||||
| 温度/℃ | 27 | 2 000 | 25 | 350 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 1.847 | 0.507 | 0.152 |
A.常温下,大气固氮和工业固氮都能非常容易进行
B.常温下,大气固氮与工业固氮完成程度相差不大
C.工业固氮时温度越低,氮气与氧气反应越完全
D.K越大说明合成氨反应的速率越大
Ⅱ. 科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航天航空。如下图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导正极生成的O2-。
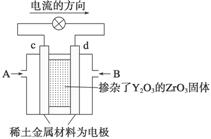
(1)c电极的名称为________。
(2)d电极上的电极反应式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com