
����Ŀ��A(C3H6)�ǻ����л�����ԭ�ϡ���A�Ʊ��ۺ���C��![]() �ĺϳ�·��(���ַ�Ӧ������ȥ)��ͼ��ʾ��
�ĺϳ�·��(���ַ�Ӧ������ȥ)��ͼ��ʾ��

��֪�� ��R��C
��R��C![]() N
N![]() R��COOH
R��COOH
�ش��������⣺
(1)A��������___��B���еĹ����ŵ�������___��
(2)C�Ľṹ��ʽΪ___��D��E�ķ�Ӧ����Ϊ___��
(3)E��F�Ļ�ѧ����ʽΪ___��
(4)![]() �������___��ԭ�ӹ�ƽ�棬
�������___��ԭ�ӹ�ƽ�棬![]() �������۷�Ӧ�����л���Ľṹ��ʽΪ___��
�������۷�Ӧ�����л���Ľṹ��ʽΪ___��
(5)B��ͬ���칹���У���B������ͬ�Ĺ��������ܷ���������Ӧ�����к˴Ź�������Ϊ3��壬�ҷ����֮��Ϊ6��1��1����___(д�ṹ��ʽ)��
(6)�����Ŀ��Ϣ������ϩ��HBrΪ��ʼԭ���Ʊ����ᣬ��ƺϳ�·��___(���Լ���ѡ)��
�ϳ�·������ͼʾ����CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3��
CH3COOCH2CH3��
���𰸡���ϩ ̼̼˫�������� 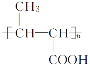 ȡ����Ӧ(��ˮ�ⷴӦ)
ȡ����Ӧ(��ˮ�ⷴӦ) 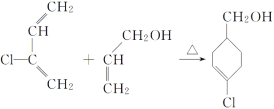 10
10 ![]()
![]() CH2=CH2
CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2CN
CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
��������
��������ͼ���ɸ߾���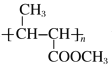 �ṹ�ص����֪���ø߾�������Bͨ���Ӿ۷�Ӧ�õ��ģ����B�Ľṹ��ʽΪCH3CH=CHCOOCH3���߾���
�ṹ�ص����֪���ø߾�������Bͨ���Ӿ۷�Ӧ�õ��ģ����B�Ľṹ��ʽΪCH3CH=CHCOOCH3���߾���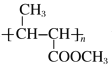 �ṹ�к�����������NaOH��Һ�й��ȷ�������ˮ�ⷴӦ�����ữ�����Ȼ�����C�Ľṹ��ʽΪ
�ṹ�к�����������NaOH��Һ�й��ȷ�������ˮ�ⷴӦ�����ữ�����Ȼ�����C�Ľṹ��ʽΪ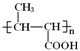 ��������ϳɷ�����˼������G
��������ϳɷ�����˼������G![]()
![]() ���ϡ���֪����Ϣ��-CNת��Ϊ-COOH�Ĺ��̣�����֪GΪ
���ϡ���֪����Ϣ��-CNת��Ϊ-COOH�Ĺ��̣�����֪GΪ![]() ��Eת��ΪF���ϡ���֪����Ϣ��ϩ�����ӳɣ���FΪ
��Eת��ΪF���ϡ���֪����Ϣ��ϩ�����ӳɣ���FΪ![]() ��EΪCH2=CHCH2OH��D��A��Cl2�ķ�Ӧ���D������NaOHˮ��Һ����ת��ΪCH2=CHCH2OH���ù���ӦΪ±����ˮ�ⷴӦ���ɴ��ǻ�������DΪCH2=CHCH2Cl���ɵ�A�Ľṹ��ʽΪCH2=CHCH3��
��EΪCH2=CHCH2OH��D��A��Cl2�ķ�Ӧ���D������NaOHˮ��Һ����ת��ΪCH2=CHCH2OH���ù���ӦΪ±����ˮ�ⷴӦ���ɴ��ǻ�������DΪCH2=CHCH2Cl���ɵ�A�Ľṹ��ʽΪCH2=CHCH3��
(1) ͨ�����Ϸ���֪��AΪCH2=CHCH3�������DZ�ϩ��B�ṹ��ʽΪCH3CH=CHCOOCH3�����й�����������̼̼˫����������
(2)C�Ľṹ��ʽΪ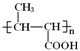 ��D����ˮ�ⷴӦ��ȡ����Ӧ����E��D��E�ķ�Ӧ����Ϊȡ����Ӧ(��ˮ�ⷴӦ)��
��D����ˮ�ⷴӦ��ȡ����Ӧ����E��D��E�ķ�Ӧ����Ϊȡ����Ӧ(��ˮ�ⷴӦ)��
(3)���ݷ�����֪E��F��������֪����Ϣ��ϩ�����ӳɣ���ѧ����ʽΪ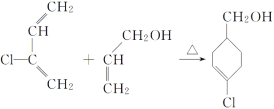
(4)![]() �����к���2��ͨ��C-C���ӵ�
�����к���2��ͨ��C-C���ӵ�![]() �ṹ������
�ṹ������![]() ��ƽ��ͨ��������ת����ƽ�棬���Ը÷���������ԭ�ӿ��ܴ���ͬһƽ���ϣ���������10��ԭ�ӹ�ƽ�棬
��ƽ��ͨ��������ת����ƽ�棬���Ը÷���������ԭ�ӿ��ܴ���ͬһƽ���ϣ���������10��ԭ�ӹ�ƽ�棬![]() ���Ӽ��Ȼ��봼�ǻ�֮��������ˮ�γɸ߷��ӣ��������۷�Ӧ�����ɸ߾���Ľṹ��ʽΪ
���Ӽ��Ȼ��봼�ǻ�֮��������ˮ�γɸ߷��ӣ��������۷�Ӧ�����ɸ߾���Ľṹ��ʽΪ![]() ��
��
(5)B�ṹ��ʽΪCH3CH=CHCOOCH3��B��ͬ���칹���У���B������ͬ�Ĺ��������ܷ���������Ӧ��˵������̼̼˫����������ȩ����Ϊ������������������ͬ���칹����HCOOCH=CHCH2CH3��HCOOCH2CH=CHCH3��HCOOCH2CH2CH=CH2��HCOOC(CH3)=CHCH3��HCOOCH=C(CH3)2��HCOOC(CH3)CH=CH2��HCOOCHC(CH3)=CH2��HCOOCH(CH2CH3)=CH2�����к˴Ź�������Ϊ3��壬�ҷ����֮��Ϊ6��1��1����![]() ��
��
(6) CH2=CH2��HBr�����ӳɷ�Ӧ����CH3CH2Br��CH3CH2Br��NaCN����ȡ����Ӧ����CH3CH2CN��CH3CH2CN�ڼ��������·���ˮ�ⷴӦȻ���ữ�õ�CH3CH2COOH��������ϳ�·��ΪCH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2CN
CH3CH2CN![]() CH3CH2COOH��
CH3CH2COOH��


 ��ǰ����ϵ�д�
��ǰ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�úͲ������ش��й����⡣

��ͼ����ʾװ�ã������ֲ�ͬ�IJ����ֱ����ʵ�飬�۲�B�����е�����
(1)�ȼн�ֹˮ��a����ʹA�����п�ʼ��Ӧ����ʵ����B�����й۲쵽��������_________________��
��B�����з�����Ӧ�����ӷ���ʽ��____________________________________��
(2)��ֹˮ��a��ʹA������ʼ��Ӧһ��ʱ����ټн�ֹˮ��a����ʵ���й۲쵽��������__________����B�����з�����Ӧ�����ӷ���ʽ��________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������ȡ�������������������100 mL 1.7mol/L��NaOH��Һ��ȫ���ա������պ����Һ���з������飬��֪c(OH-)=0.1mol/L (�����Ƿ�Ӧǰ����Һ������仯) ��ClO����ClO3�������ʵ���Ũ��֮��Ϊ5��1����ش�
��1�������������ĵ�NaOH�����ʵ���Ϊ_______________mol��
��2�������������������ʵ���Ϊ_______________mol������ԭ�����������ʵ���Ϊ _______________mol��
��3�������ö������̺�Ũ���Ṳ�ȵķ������������Ʊ�β���е����������ĵĶ������̵�����Ϊ_______________g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����3�������Ϊ2.0 L�ĺ����ܱ������У���ӦCO2(g)��C(s)![]() 2CO(g)��H>0���ֱ���һ���¶��´ﵽ��ѧƽ��״̬������˵����ȷ����
2CO(g)��H>0���ֱ���һ���¶��´ﵽ��ѧƽ��״̬������˵����ȷ����
���� | �¶�/K | ��ʼʱ���ʵ���/mol | ƽ��ʱ���ʵ���/mol | ||
n(CO2) | n(C) | n(CO) | n(CO) | ||
I | 977 | 0.28 | 0.56 | 0 | 0.4 |
II | 977 | 0.56 | 0.56 | 0 | x |
III | 1250 | 0 | 0 | 0.56 | y |
A.977K���÷�Ӧ�Ļ�ѧƽ�ⳣ��ֵΪ2
B.�ﵽƽ��ʱ��������I������C������ƽ�������ƶ�
C.�ﵽƽ��ʱ����������CO2��ת���ʱ��������еĴ�
D.�ﵽƽ��ʱ���������е�CO��ת���ʴ���28.6%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѧ�Ļ�ѧ֪ʶ�ش��������⣺
(1)Na��Mg��Al�е�һ������������___(��Ԫ�ط���)��Feԭ�ӻ�̬�����Ų�ʽΪ___��
(2)���з�Ӧ�����ڼ��˾���Ƿ�ƺ��ʻ��2Cr2O![]() +3CH3CH2OH+16H++13H2O��4[Cr(H2O)6]3++3CH3COOH
+3CH3CH2OH+16H++13H2O��4[Cr(H2O)6]3++3CH3COOH
�������[Cr(H2O)6]3+�У���Cr3+�γ���λ����ԭ����___(��Ԫ�ط���)��
��1molCH3COOH���Ӻ�����������ĿΪ___NA��
��H2O��CH3CH2OH��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ___��
(3)SԪ�ص��������������̬ʱ�Ե�������ʽ���ڣ�����ԭ�ӵ��ӻ���ʽΪ___�ӻ�������ӵ����幹��Ϊ___��H2O��H2S��H2Se�е��ɵ͵��ߵ�˳��___��
(4)��Cu�ķ�ĩ����Ũ��ˮ�У�ͨ��O2����ַ�Ӧ����Һ������ɫ���÷�Ӧ�����ӷ���ʽ��___��
(5)����Ԫ��X�ͷǽ���Ԫ��Y����ij������ľ�����ͼ(X�ð����ʾ��Y�ú����ʾ)����û�����Ļ�ѧʽΪ___��
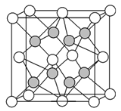
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ����
A.�ö��Ե缫���CuCl2��Һ��Cu2����2Cl����2H2O![]() Cu(OH)2����H2����Cl2��
Cu(OH)2����H2����Cl2��
B.��FeBr2��Һ��ͨ�����Cl2��2Fe2++4Br��+2Cl2=2Fe3++2Br2+4Cl��
C.�����������Һ�м���Ba(OH)2��Һ�����ԣ�2H++ SO42��+Ba2++2OH��=BaSO4��+2H2O
D.NH4HCO3��Һ�����NaOH��Һ��Ӧ��NH4+ +OH��=NH3��+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������0.22 mol X������0.16 mol Y����5 L�����ܱ������У�������Ӧ2X(g) + Y(g) ![]() 2Z(g) ��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
2Z(g) ��H<0��һ��ʱ���ﵽƽ�⣬��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����( )
A. ���¶��´˷�Ӧ��ƽ�ⳣ��K = 72.0 L/mol
B. ��Ӧǰ2 min��ƽ�����ʦ�(Z) = 4.0��10-3 mol/(L��min)
C. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰ��(��) > ��(��)
D. �����������䣬�ٳ���0.1 mo1 X����ƽ��ʱX��ת���ʽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ��2SO2(g)��O2(g)![]() 2SO3(g)�����д�ʩ��ʹ��Ӧ���л���Ӱٷ�������ѧ��Ӧ���ʺͻ�ѧƽ�ⳣ�����仯���ǣ� ��
2SO3(g)�����д�ʩ��ʹ��Ӧ���л���Ӱٷ�������ѧ��Ӧ���ʺͻ�ѧƽ�ⳣ�����仯���ǣ� ��
A. ����ѹǿ B. �����¶� C. ʹ�ô��� D. ���O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���̬���ӶϿ�1mol��ѧ�������������Ϊ���ܡ���֪H-H��H-O����O=O���ļ��ֱܷ�Ϊ436kJ/mol��463kJ/mol��495kJ/mol�������Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A.H2O��g��=H2��g��+![]() O2��g����H=-485kJ/mol
O2��g����H=-485kJ/mol
B.H2O��g��=H2��g��+![]() O2��g����H=+485kJ/mol
O2��g����H=+485kJ/mol
C.2H2��g��+O2��g��=2H2O��g����H=+485kJ/mol
D.2H2��g��+O2��g��=2H2O��g����H=-485kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com